-
(17分)氮及其化合物在工业生产和科技等领域有广泛应用。
(1)肼(N2H4)常用于火箭或原电池的燃料。已知:(i)N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ/mol
(ii)N2H4(g)+ O2(g) N2(g)+2H2O(g) ΔH=-534kJ/mol
N2(g)+2H2O(g) ΔH=-534kJ/mol
(iii)H2O(g)= H2O(1) ΔH=-44kJ/mol
①反应2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l) ΔH =_______kJ·mol-1
②一定温度下,将N2H4与NO2以体积比1:1置于10 L密闭容器中发生反应2N2H4(g)+ 2NO2(g) 3N2(g)+4H2O(1),下列不能说明反应达到平衡状态的是_______。(填序号)
3N2(g)+4H2O(1),下列不能说明反应达到平衡状态的是_______。(填序号)
a.混合气体密度保持不变 b.混合气体颜色保持不变
c.N2H4与NO2体积比保持不变 d.体系压强保持不变
③在10 L的密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:

前2min内NO2的平均反应速率为___________。平衡时NO2的转化率________;该温度下反应的平衡常数K=_________。
反应在第6min时改变了条件,改变的条件可能是__________。(填序号)
a.使用催化剂 b.升高温度 c.减小压强 d.增加NO2的量
(2)HNO3和As2S3能发生反应:As2S3+10HNO3==2H3AsO4+3S+10NO2↑+2H2O,反应中被氧化的元素为_________。
若该反应中转移电子的物质的量为5 mol时,产物中的S经过转化全部生成浓H2SO4,然后与足量的铜在加热条件下反应消耗铜的量_________。(填序号)
a.小于0.75 mol b.等于0.75mol c.大于0.75mol d.无法确定
-
某液态肼(N2H4)燃料电池被广泛应用于发射通讯卫星、战略导弹等运载火箭中。以固体氧化物为电解质,生成物为无毒无害的物质。下列有关该电池的说法不正确的是( )
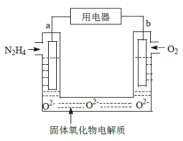
A.a电极上的电极反应式为N2H4+2O2--4e-=N2↑+2H2O
B.电子流动方向:电极a→电极b
C.b极附近的pH值变大
D.当电极a上消耗1molN2H4时,电极b上被还原的O2在标准状况下体积为22.4L
-
(14分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H= 。(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。
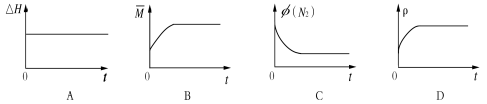
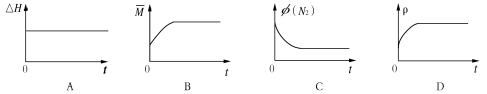
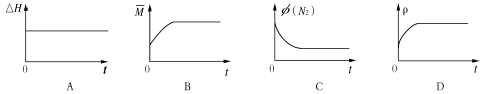
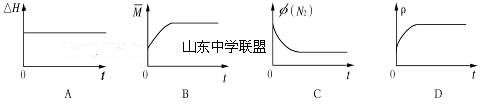
③下列图像分别代表焓变(△H)、混合气体平均相对分子质量( )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
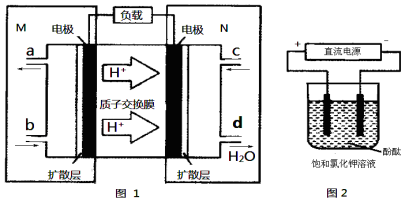
(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。
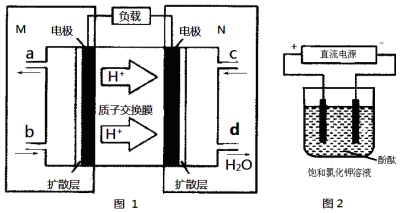
①M区发生的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为 g(假设溶液电解前后体积不变)。
-
(14分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l)  H1
H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l)  H2
H2
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)  H= 。(请用含有
H= 。(请用含有 H1、
H1、 H2的式子表示)
H2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。
③下列图像分别代表焓变(H)、混合气体平均相对分子质量( )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。

(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。
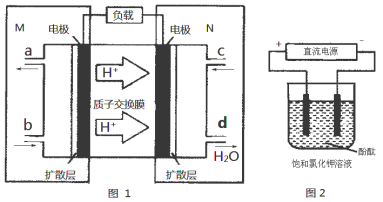
①M区发生的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500 mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量
为 g(假设溶液电解前后体积不变)。
-
(14分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H= 。(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。
③下列图像分别代表焓变(△H)、混合气体平均相对分子质量( )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。
①M区发生的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为 g(假设溶液电解前后体积不变)。
-
联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。回答下列问题:
(1)联氨分子的电子式为 ,其中氮的化合价为 。
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为 。
(3)①2O2(g)+N2(g)==N2O4(l) △H1
②N2(g)+2H2(g)==N2H4(l) △H2
③O2(g)+2H2(g)==2H2O(g) △H3
④2N2H4(l)+N2O4(l)==3N2(g)+4H2O(g) △H4=-1048.9kJ-mol-1
上述反应热效应之间的关系式为△H4= ,联氨和N2O4可作为火箭推进剂的主要原因为 。
(4)联氨为二元弱碱,在水中的电离方式与氨相似。联氨第一步电离反应的平衡常数值为 (已知:N2H4+H+ N2H5+的K=8.7xl07; Kw=1.0xl0-14)。联氨与硫酸形成的酸式盐的化学式为 。
N2H5+的K=8.7xl07; Kw=1.0xl0-14)。联氨与硫酸形成的酸式盐的化学式为 。
(5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是 。联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O2 kg;与使用Na2S03处理水中溶解的O2相比,联氨的优点是 。
-
氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H= 。(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)。
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。
③下列图像分别代表焓变(△H)、混合气体平均相对分子质量( )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。
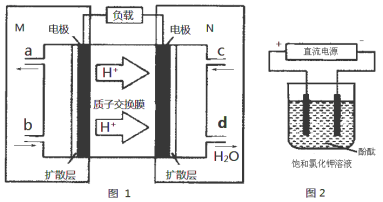
①M区发生的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定) ,若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为 g(假设溶液电解前后体积不变)。
,若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为 g(假设溶液电解前后体积不变)。
-
氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) ΔH2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ΔH= 。(请用含有ΔH1、ΔH2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
| 温度/K | 平衡时NH3的物质的量/mol |
| T1 | 2.4 |
| T2 | 2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。
③下列图像分别代表焓变(ΔH)、混合气体平均相对分子质量( )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明一段时间后该可逆反应达到了平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明一段时间后该可逆反应达到了平衡状态的是 。
(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。
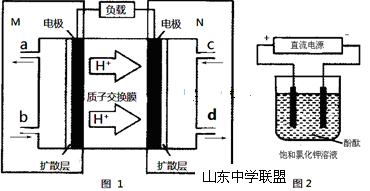
①M区发生的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为 g(假设溶液电解前后体积不变)。
-
联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为__________,其中氮的化合价为______。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的离子方程式____________。
(3)联氨和N2O4可作为火箭推进剂,其反应的产物均无污染。其氧化产物和还原产物之比为 _______。
(4)联氨为二元弱碱,在水中的电离方程式与氨相似。联氨与硫酸形成的酸式盐的化学式为______________。
-
联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。回答下列问题:
(1)联氨分子的电子式为_________,其中氮的化合价为__________。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为______________。
(3)①2O2(g)+N2(g)= N2O4(l) △H1
②N2(g)+2H2(g)= N2H4(g) △H2
③O2(g)+ 2H2(g)=2H2O(g) △H3
④2 N2H4(g)+ N2O4(l)=3N2(g)+4H2O(g) △H4=-1048.9kJ/mol
上述反应热效应之间的关系式为△H4=_________,联氮和N2O4可作为火箭推进剂的主要原因为__________。
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为_________(已知:N2H4+H+=== N2H5+ 的K=8.7×107;Kw=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为______________。
(5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加人联氨溶液,观察到的现象是_______________。联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O2________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是_________。
N2(g)+2H2O(g) ΔH=-534kJ/mol
3N2(g)+4H2O(1),下列不能说明反应达到平衡状态的是_______。(填序号)











