-
氢气在工业合成中广范应用。
(1)通过下列反应可以制备甲醇:
CO(g)+2H2(g) CH3OH(g) ΔH=-90.8kJ/mol,
CH3OH(g) ΔH=-90.8kJ/mol,
CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.3kJ/mol
CO(g)+H2O(g) ΔH=+41.3kJ/mol
请写出由CO2和H2制取甲醇的热化学方程式______________。
(2)己知合成氨的反应为:N2+3H2 2NH3 △H<0。某温度度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和怛容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请冋答下列问题:
2NH3 △H<0。某温度度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和怛容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请冋答下列问题:
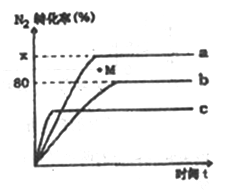
①图中代表反应在恒容绝热容器中进行的曲线是________(用a、b、c表示)。
②曲线a条件下该反应的平衡常数K=_____________。
③b容器中M点,v(正)________v(逆)(填“大于”、“小于”或“等于”)。
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2。阴极电极反应式为________;标准状况下,当阴极收集到11.2LN2时,理论上消耗NH3的体积为_____________。
(4)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中c(NH4+)____ c(HCO3-) (填“>”、“<”或“=”);反应NH4++HCO3-+H2O NH3•H2O+H2CO3的平衡常数K=_______。
NH3•H2O+H2CO3的平衡常数K=_______。
(已知常温下NH3•H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7, K2=4×10-11)
-
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)═CH3OH(g) △H=-90.8 kJ/mol。
(1)T℃下上述反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
①该时间段内反应速度v(H2)= 。
②升高温度后,K (填“>”“<”或“=”)160。
③比较此时正、逆反应速率的大小:
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)①若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用合适的催化剂
D.充入 ,使体系总压强增大
,使体系总压强增大
②下列情形能说明该反应已达到平衡状态的是 (填序号).
A.每消耗1mol CO的同时生成2molH2
B.容器中混合气体的密度不随时间而变化
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
(3)已知在常温常压下:已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-akJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-bkJ•mol-1
③H2O(g)=H2O(l)△H=-ckJ•mol-1
则CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=_________
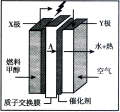
(4)甲醇燃烧电池容易携带、容易存储等优点,目前被认为将会替代传统的电池成为携带型设备的主要电源。右图是甲醇的质子交换燃料电池膜型,X极的电极反应式为 ,空气以20%为氧气计算, 极每消耗1
极每消耗1 甲醇,Y极必须消耗标准状况下 L空气中的氧气。
甲醇,Y极必须消耗标准状况下 L空气中的氧气。
-
甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO ( g ) + 2H2 ( g )  CH3OH ( g ) △H =-90.8 kJ·mol-1 在一容积可变的 密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
CH3OH ( g ) △H =-90.8 kJ·mol-1 在一容积可变的 密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
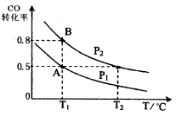
(1)该反应的化学平衡常数表达式为 。
(2)如反应开始时仍充入10mol CO 和20mol H2,
则在平衡状态B时容器的体积V(B)= L。
(3)关于反应CO(g)+2H2(g) CH3OH(g)在化学平衡状态时的描述正确的是 (填字母)。
CH3OH(g)在化学平衡状态时的描述正确的是 (填字母)。
A.CO的含量保持不变
B.容器中CH3OH浓度与CO浓度相等
C.2V正(CH3OH)=V正(H2)
D.容器中混合气体的平均相对分子质量保持不变
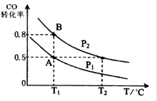
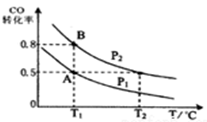
(4)CO(g)+2H2(g) CH3OH(g),按照相同的物质的量 投料,测得CO在 不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是 。
CH3OH(g),按照相同的物质的量 投料,测得CO在 不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是 。
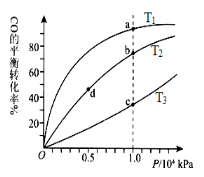
A.温度:T1 < T2 <T3
B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数: K(a) =K(c) ; K(b) >K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(5)已知CO2(g)+H2(g) CO(g)+H2O(g) △H= + 41.3 kJ·mol-1 ,试写出由 CO2和H2制取甲醇的热化学方程式 。
CO(g)+H2O(g) △H= + 41.3 kJ·mol-1 ,试写出由 CO2和H2制取甲醇的热化学方程式 。
-
甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO ( g ) + 2H2 ( g )  CH3OH ( g ) △H =-90.8 kJ·mol-1 在一容积可变的 密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
CH3OH ( g ) △H =-90.8 kJ·mol-1 在一容积可变的 密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
(1)该反应的化学平衡常数表达式为________。
(2)如反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)= ________________ L。
(3)关于反应CO(g)+2H2(g) CH3OH(g)在化学平衡状态时的描述正确的是________(填字母)。
CH3OH(g)在化学平衡状态时的描述正确的是________(填字母)。
A.CO的含量保持不变 B.容器中CH3OH浓度与CO浓度相等
C.2V正(CH3OH)=V正(H2)D.容器中混合气体的平均相对分子质量保持不变
(4)CO(g)+2H2(g) CH3OH(g),按照相同的物质的量 投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是________。
CH3OH(g),按照相同的物质的量 投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是________。
A.温度:T1 < T2 <T3
B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数: K(a) =K(c) ; K(b) >K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(5)已知CO2(g)+H2(g) CO(g)+H2O(g) △H= + 41.3 kJ·mol-1 ,试写出由
CO(g)+H2O(g) △H= + 41.3 kJ·mol-1 ,试写出由
CO2和H2制取甲醇的热化学方程式________。
-
(12分)甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO ( g )+2H2 ( g )  CH3OH ( g )
CH3OH ( g )  H=-90.8 kJ·mol-1,在一容积可变的密闭容器中充入10 mol CO 和20 mol H2,CO 的 平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态B 时,容器的体积为4 L。
H=-90.8 kJ·mol-1,在一容积可变的密闭容器中充入10 mol CO 和20 mol H2,CO 的 平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态B 时,容器的体积为4 L。
(1)该反应的化学平衡常数表达式为 。
(2)如反应开始时仍充入10 mol CO 和20 mol H2,则在平衡状态A时,容器的体积V(A)= L。
(3)关于反应CO(g)+2H2(g) CH3OH(g)建立化学平衡状态时的标志是 (填字母)。
CH3OH(g)建立化学平衡状态时的标志是 (填字母)。
A.CO的含量保持不变
B.容器中CH3OH浓度与CO浓度相等
C.2V正(CH3OH)=V正(H2)
D.容器中混合气体的平均相对分子质量保持不变
(4)已知CO2(g)+H2(g) CO(g)+H2O(g) H=+41.3 kJ·mol-1 ,试写出由CO2和H2制取甲醇的热化学方程式 。
CO(g)+H2O(g) H=+41.3 kJ·mol-1 ,试写出由CO2和H2制取甲醇的热化学方程式 。
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。
实验室用下图装置模拟上述过程:
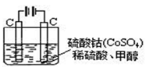
①写出阳极的电极反应式______________ _。
②写出除去甲醇的离子方程式_______________ ___。
-
工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g) +2H2(g)  CH3OH(g) △H =-90.8 kJ·mol-1
CH3OH(g) △H =-90.8 kJ·mol-1
300℃时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1 molCO、2 mol H2 | 1mol CH3OH | 2mol CH3OH |
| 平衡 时 数据 | CH3OH的浓度(mol·L-1) | c1 | c2 | c3 |
| 反应的能量变化 | a kJ | bkJ | ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |
| | | | |
下列说法正确的是
A. 2c1>c3 B. ∣a∣+∣b∣=90.8
C. 2p2<p3 D. a1+ a3<1
-
工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g) +2H2(g)  CH3OH(g) △H =-90.8 kJ·mol-1
CH3OH(g) △H =-90.8 kJ·mol-1
300℃时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1 molCO、2 mol H2 | 1mol CH3OH | 2mol CH3OH |
| 平衡 时 数据 | CH3OH的浓度(mol·L-1) | c1 | c2 | c3 |
| 反应的能量变化 | a kJ | bkJ | ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |
下列说法正确的是
A. 2c1>c3 B. ∣a∣+∣b∣=90.8
C. 2p2<p3 D. a1+ a3<1
-
请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)工业上可利用CO或CO2来制备清洁液体燃料甲醇。已知: 800℃时
反应①:2H2(g)+CO(g) CH3OH(g) △H=-90.8 kJ/mol
CH3OH(g) △H=-90.8 kJ/mol
反应②:H2(g)+CO2(g) H2O(g)+CO(g) △H=+41.2kJ/mol
H2O(g)+CO(g) △H=+41.2kJ/mol
(1)写出用CO2与H2反应制备甲醇的热化学方程式___________________________________。
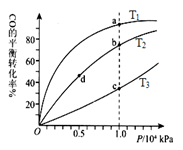
(2)对于反应①,在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图1所示。据此判断
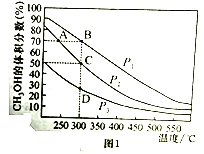
①压强P1_____P2(填“>”“<”或“=”,下同)
②平衡常数K(状态C)_____K(状态D)
③反应速率:V逆(状态A)_____V逆(状态B)
(3)对于反应②,在体积一定的密闭容器中加入一定量的H2和CO。进行反应。下列说法正确的是______。
A.若该反应在恒容,绝热的容器中进行,当容器中压强保持不变时表明反应达到平衡状态
B.该反应达到平衡时,向平衡体系中充入一定量的氦气,平衡可能发生移动
C.恒温恒容条件下,若改变反应物的投入量,△H的值不发生变化
D.恒温恒容条件下,若投入气体的总量保持不变,设起始投料比[n(H2)/n(CO2)]=X,当X=2或1/2时,H2O的体积分数不变。
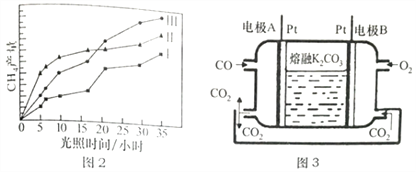
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外线照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化如下图2所示,在0-15h内,对反应催化效果最好的催化剂是____________(填序号)。
(5)一种新利CO燃料电池工作原理如上图3所示,该电池负极电极反应式为______________,电极A处产生的CO2有部分参与循环利用,其利用率为______________________。
-
工业上用CO与H2合成甲醇,CO(g)+2H2(s) CH3OH(g) △H=—90.8kJ/mol。300℃时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
CH3OH(g) △H=—90.8kJ/mol。300℃时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
| 容量 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1 molCO、2molH2 | 1mol CH3OH | 2mol CH3OH |
| 平衡时数据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | a kJ | b kJ | c kJ |
| 体系压强(Pa) | P1 | P2 | P3 |
| 反应物转化率 | a1 | a2 | a3 |
下列说法正确的是
A.2c1>c3 B.a+b<90.8 C.2P2<P3 D.a1+a3<1
-
甲醇是一种重要的化工原料,有着重要的用途和应用前景。请回答下列问题:
(1)工业生产甲醇的常用方法是CO(g)+2H2(g) CH3OH(g) ΔH=-90.8 kJ·mol-1。
CH3OH(g) ΔH=-90.8 kJ·mol-1。
已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1;
H2(g)+ O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1;
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1;
2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ·mol-1;
CH3OH(g)===CH3OH(l) ΔH=-37.3 kJ·mol-1。
计算液体CH3OH的燃烧热为 。
(2)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理,在硝化细菌的作用下将NH 氧化为
氧化为
NO (2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO
(2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO 反应转化为两种无毒气体。写出加入甲醇后反应的离子方程式: 。
反应转化为两种无毒气体。写出加入甲醇后反应的离子方程式: 。
(3)甲醇不完全燃烧产生的CO可利用I2O5来除去,其反应为5CO(g)+I2O5(s) 5CO2(g) +I2(s)。不
5CO2(g) +I2(s)。不
同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得的CO2体积分数随着时间
t变化曲线如图所示。则:
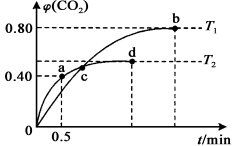
①T2温度时,0~0.5 min的反应速率v(CO)= 。
②T1温度时,反应达到平衡,CO的转化率为 ,化学平衡常数K= (用具体数值表示)。
③下列说法正确的是 (填编号)。
A.容器内压强不变,表明反应达到平衡状态
B.容器内气体密度不变,表明反应达到平衡状态
C.单位时间内,消耗a mol CO,同时消耗2a mol CO2, 表明反应v(正)<v(逆)
D.两种温度下,c点时体系中混合气体的压强相等
E.反应5CO(g)+I2O5(s) 5CO2(g)+I2(s)为吸热反应
5CO2(g)+I2(s)为吸热反应
(4)将500 mL(标准状况)甲醇不完全燃烧产生的气体样品通过盛有足量I2O5的干燥管,170 ℃下充分反应,用水—乙醇液充分溶解产物I2,定容到100 mL。取25.00 mL,用0.0100 mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00 mL,则样品气中CO的体积分数为 。(已知:气体样品中其他成分与I2O5不反应;2Na2S2O3+I2=2NaI+Na2S4O6)
CH3OH(g) ΔH=-90.8kJ/mol,
CO(g)+H2O(g) ΔH=+41.3kJ/mol
2NH3 △H<0。某温度度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和怛容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请冋答下列问题:

NH3•H2O+H2CO3的平衡常数K=_______。









