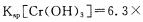-
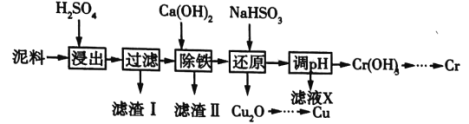
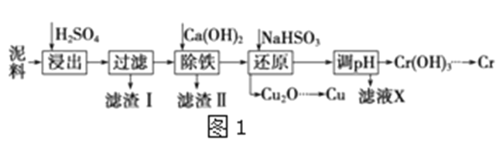
工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶性杂质)回收铜和铬等金属,回收流程如图所示:
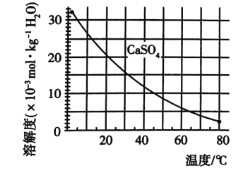
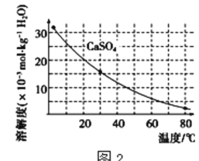
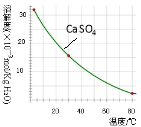
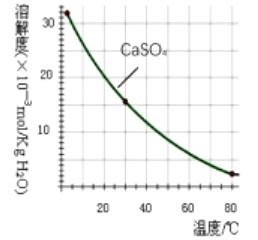
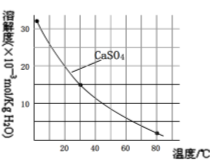
已知部分物质沉淀的pH(如表)及CaSO4元的溶解度曲线(如图):
| Fe3+ | Cu2+ | Cr3+ |
| 开始沉淀 | 2.1 | 4.7 | 4.3 |
| 完全沉淀 | 3.2 | 6.7 | 5.6 |
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有_____________(填化学式)。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH到______;
②将浊液加热到80℃,____________。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子方程式:_________,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是______________。
-
工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如图1:
已知部分物质沉淀的pH及CaSO4的溶解度曲线如图2:
| Fe3+ | Cu2+ | Cr3+ |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有__;
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH到约__,检验Fe3+已经除尽的操作是__;②将浊液加到80℃,__;
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式__,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是__;
(4)在FeS饱和溶液中存在:FeS(s) Fe2+(aq)+S2-(aq),常温下FeS的Ksp=6.25×10-18。又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:c2(H+)•c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1mol•L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)为___。
Fe2+(aq)+S2-(aq),常温下FeS的Ksp=6.25×10-18。又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:c2(H+)•c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1mol•L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)为___。
-
(14分)铜、铬都是用途广泛的金属。工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收金属铜和铬的流程如下图:

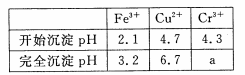
已知:部分物质沉淀的pH如下表:
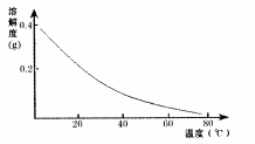
CaSO4的溶解度曲线如图:
请回答下列问题:
(1)滤液I中所含溶质主要有 (填化学式)。
(2)第②步操作中,先加人Ca(OH)2调节溶液的pH,调节范围为____,然后将浊液加热至80 ℃ 趁热过滤,所得滤渣Ⅱ的成分为 。
(3)第③步操作中,发现除了生成砖红色沉淀外,还产生了无色刺激性气味的气体。写出该步骤中发生反应的离子方程式
(4)当离子浓度≤1× 10-5mol· L-1 l时,可以认为离子沉淀完全。第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值为 。(已知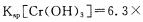
(5)Cr(OH)3受热分解为Cr2O3,用铝热法可以冶炼金属铬。写出铝热法炼铬的化学方程式
-
工业上利用电镀污泥 (主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下:
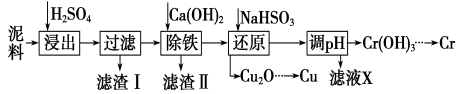
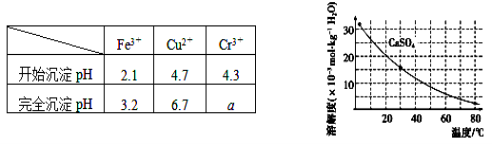
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有__________________。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH到约________,检验Fe3+已经除尽的操作是_________________;
②将浊液加热到80℃,______________________。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式: ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是_______。
(4)当离子浓度小于或等于1×10-5mol·L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持 c(OH-)≥______。[已知:Ksp[Cr(OH)3]=6.3×10-31, ≈4.0]。
≈4.0]。
-
工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下:
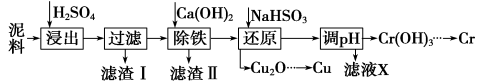
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:

(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有 。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH范围 ,检验Fe3+已经除尽的操作是 ;
②将浊液加热到80℃, 。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式: ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是 。
(4)当离子浓度小于或等于1×10-5 mol·L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH-)≥ 。[已知:Ksp[Cr(OH)3] = 6.3×10-31, ≈4.0]。
≈4.0]。
-
工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下: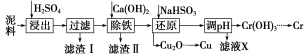
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:

(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有__________________。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH到约____________,检验Fe3+已经除尽的操作是__________________;
②将浊液加热到80℃,______________________。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式:___________,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是________。
(4)当离子浓度小于或等于1×10-5mol·L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH-)≥______。[已知:Ksp[Cr(OH)3]=6.3×10-31, ≈4.0]
≈4.0]
-
工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下:
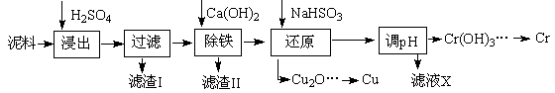
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
| Fe3+ | Cu2+ | Cr3+ |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH到 ;②将浊液加热到80℃, 。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子反应方程式 ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是 。
(4)当离子浓度≤1×10—5 mol•L-1认为沉淀完全,若要使Cr3+完全沉淀则要保持C(OH—)≥ 。已知:Ksp[Cr(OH)3]=6.3×10-31, )
)
-
电镀行业中废水处理后产生的含重金属污泥废弃物称为电镀污泥,被列入国家危险废物名单中的第十七类危险废物。工业上可利用某电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金金属,其利用回收流程如下:
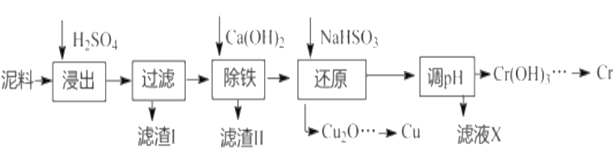
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
| Fe3+ | Cu2+ | Cr3+ |
| 开始沉淀的pH | 2.1 | 4.7 | 4.3 |
| 恰好完全沉淀的pH | 3.2 | 6.7 | a |
(1)浸出过程中的生成物主要是Fe2(SO4)3和_______________(填化学式)
(2)除铁等相关操作:
①加入石灰乳调节pH应满足要求是_______________;
②将浊液加热到80℃,趁热过滤。滤渣Ⅱ的主要成分是______________(填化学式)。
(3)还原步骤中生成Cu2O固体的离子反应方程式______________,此步骤中加入NaHSO3的不能过量______________ (离子方程式表达)。
(4)当离子浓度≤1×10-5mol·L-1时认为沉淀完全,则表格中a的值是______________。(已知:T=25℃,Ksp[Cr(OH)3]=6.3×10-31, ,lg2=0.3)
,lg2=0.3)
(5)将铬块加入到稀盐酸或稀硫酸中,可观察到铬逐渐溶解,同时放出氢气。但若将铬块加稀硝酸中,却看不到明显现象。由此推测,出现该现象的可能原因是____________________________。
(6)处理大量低浓度的含铬废水(以CrO42-计)可采用离子交换法,其原理是采用季胺型强碱性阴离子交换树脂(RN—OH),使庞水中CrO42-与树脂上的OH发生离子交换反应。一段时间后停lh 通废水,再通NaOH溶液时CrO42-进入溶液回收,并使树脂得到再生。请用离子方程式表示该交换过程____________。
-
(10分)工业上利用电解污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下:
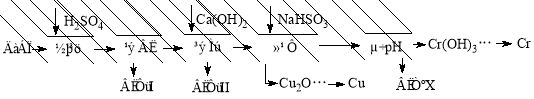
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
| Fe3+ | Cu2+ | Cr3+ |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有 。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH范围为: ~ ;②将浊液加热到80℃, 。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子反应方程式 ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是 。
-
下面是某工厂利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬的流程:
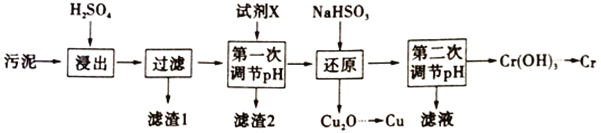
请回答下列问题:
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
(1)在浸出过程中除生成Cr2(SO4)3外,主要还生成__________________。
(2)流程中“第一次调节“pH”是为了除去Fe3+,所加试剂X可以是_______(任写一种)。当离子浓度小于或等于1×10-5时可认为沉淀完全,若要使Fe3+完全沉淀,则应调节溶液pH≥__________已知(Ksp[Fe(OH)3]=8×10-38,1g2=0.3)
(3)写出还原步骤中生成Cu2O沉淀反应的离子方程式______________________________。此步骤中若NaHSO3过量。除了浪费试剂外,还可能出现的问题是________________________。
(4)流程中“第二次调节pH”应小于9,因为Cr(OH)3是两性氢氧化物,试写出Cr(OH)3与NaOH溶液反应的离子方程式___________________________。
(5)Cr(OH)3受热分解为Cr2O3,再用铝热法可以得到金属Cr。写出其中用铝热法冶炼得到金属Cr的化学方程式________________________________。
(6)化学需氧量(COD)可量度水体受有机物污染的程度,以K2Cr2O7作强氧化剂处理水样时所消耗的K2Cr2O7的量换算成相当于O2的含量(以mg·L-1计)来计量。
①处理时,水样应先酸化,最好选用__________(选填“稀硝酸”、“稀硫酸”或“稀盐酸”)酸化。
②在该条件下,Cr2O72-最终转化为Cr3+、取水样100mL,处理该水样时消耗了10mL0.025 mol·L-1 K2Cr2O7溶液。则该水样的COD为__________ mg·L-1。


≈4.0]。