-
已知热化学方程式:①CO(g) + 1/2O2 (g)=CO2 (g) ΔH=--283.0kJ·mol-1
②H2(g) +1/2O2 (g) =H2O(g) ΔH=--241.8 kJ·mol-1
则下列说法正确的是 ( )
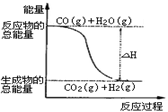
A.H2的燃烧热为241.8kJ·mol-1
B.由反应①、②可知上图所示的热化学方程式为
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=--41.2 kJ·mol-1
C.H2(g)转变成H2O(g)的化学反应一定要释放能量
D.根据②推知反应H2(g)+1/2O2(g)=H2O(l)ΔH>--241.8 kJ·mol-1
-
已知热化学方程式:
①CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
②H2(g) +1/2O2 (g) =H2O(g) ΔH=-241.8 kJ·mol-1
则下列说法正确的是
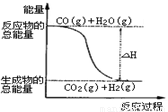
A. H2的燃烧热为241.8kJ·mol-1
B. H2(g)转变成H2O(g)的化学反应一定要释放能量
C. 由反应①、②可知上图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=+41.2 kJ·mol-
D. 根据②推知反应H2(g)+1/2O2(g)=H2O(l)ΔH<-241.8 kJ·mol-1
-
已知热化学方程式:
①CO(g)+1/2O2(g)=CO2(g)ΔH=-283.0kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
则下列说法正确的是( )
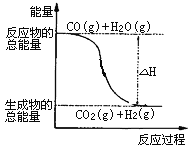
A. H2的燃烧热为241.8kJ·mol-1
B. 由反应①、②可知上图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)ΔH=-41.2 kJ·mol-1
C. H2(g)转变成H2O(g)的化学反应一定要放出能量
D. 根据②推知反应H2(g)+1/2O2(g)=H2O(l)ΔH>-241.8 kJ·mol-1
-
已知热化学方程式:①CO(g)+1/2O2(g)=CO2(g)ΔH=-283.0kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
则下列说法正确的是

A. H2的燃烧热为241.8kJ·mol-1
B. 由反应①、②可知上图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)ΔH=-41.2 kJ·mol-1
C. H2(g)转变成H2O(g)的化学反应一定要吸收能量
D. 根据②推知反应H2(g)+1/2O2(g)=H2O(l)ΔH>-241.8 kJ·mol-1
-
已知热化学方程式:①CO(g)+1/2O2(g)=CO2(g)ΔH=-283.0kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
则下列说法正确的是
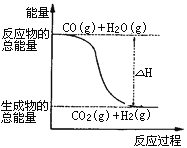
A. H2的燃烧热为241.8kJ·mol-1
B. 由反应①、②可知上图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)ΔH=-41.2 kJ·mol-1
C. H2(g)转变成H2O(g)的化学反应一定要吸收能量
D. 根据②推知反应H2(g)+1/2O2(g)=H2O(l)ΔH>-241.8 kJ·mol-1
-
已知热化学方程式:①CO(g)+1/2O2(g)=CO2(g)ΔH=-283.0kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
则下列说法正确的是
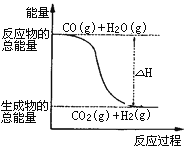
A. H2的燃烧热为241.8kJ·mol-1
B. 由反应①、②可知上图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)ΔH=-41.2 kJ·mol-1
C. H2(g)转变成H2O(g)的化学反应一定要吸收能量
D. 根据②推知反应H2(g)+1/2O2(g)=H2O(l)ΔH>-241.8 kJ·mol-1
-
已知热化学方程式:①CO(g)+ O2(g)=CO2 (g) ΔH=--283.0kJ·mol-1
O2(g)=CO2 (g) ΔH=--283.0kJ·mol-1
②H2(g)+ O2 (g) =H2O(g) ΔH=--241.8 kJ·mol-1
O2 (g) =H2O(g) ΔH=--241.8 kJ·mol-1
则下列说法正确的是
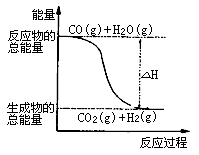
A. H2的燃烧热为241.8kJ·mol-1
B. H2(g)转变成H2O(g)的化学反应一定要释放能量
C. 由反应①、②可知上图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
D. 根据②推知反应H2(g)+  O2(g)=H2O ΔH>-241.8 kJ·mol-1
O2(g)=H2O ΔH>-241.8 kJ·mol-1
-
已知热化学方程式:
①CO(g)+ 1/2 O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
②H2(g)+1/2 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
则下列说法正确的是( )
A.H2的燃烧热为241.8kJ·mol-1
B.由反应①、②可知右图所示的热化学方程式为
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH = -41.2 kJ·mol-1
C.H2(g)转变成H2O(g)的化学反应一定要释放能量
D.根据②推知反应H2(g) +1/2O2 (g)=H2O(l);ΔH>-241.8 kJ·mol-1
-
已知热化学方程式:则下列说法正确的是
①CO(g)+ O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
②H2(g)+ O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
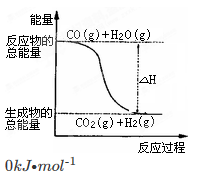
A.H2的燃烧热为241.8kJ·mol -1
B.由反应①、②可知如图所示的热化学方程式为 CO(g)+H2O(g)=CO2(g)+H2(g) ΔH =-41.2kJ·mol -1
C.H2(g)转变成H2O(g)的化学反应一定要释放能量
D.根据②推知反应H2(g) +1/2O2(g)=H2O(l):ΔH>-241.8 kJ·mol -1
-
在工业上常用CO和H2合成甲醇,反应方程式为:
CO(g)+2H2(g) CH3OH(g) △H = akJ/mol
CH3OH(g) △H = akJ/mol
已知:①CO(g)+1/2O2(g)= CO2(g) △H1=﹣283.0kJ/mol
②H2(g)+1/2O2(g)= H2O(g) △H2=﹣241.8kJ/mol
③CH3OH(g)+3/2O2(g)= CO2(g)+ 2H2O(g)△H3=﹣192.2kJ/mol
回答下列问题:
(1)a = _______
(2)能说明反应CO(g)+2H2(g) CH3OH(g)已达平衡状态的是___(填字母)。
CH3OH(g)已达平衡状态的是___(填字母)。
A.单位时间内生成1mol CH3OH(g)的同时消耗了1mol CO(g)
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,气体的平均摩尔质量不再变化
(3)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与 的关系如图1所示.
的关系如图1所示.
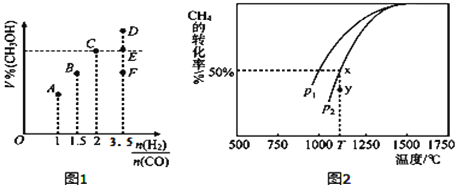
①当起始 =2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=_____________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____________(选填“增大”、“减小”或“不变”);
=2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=_____________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____________(选填“增大”、“减小”或“不变”);
②当 = 3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_______点(选填“D”、“E”或“F”)。
= 3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_______点(选填“D”、“E”或“F”)。
(4)CO和H2来自于天然气。已知CO2(g)+CH4(g) 2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1mol•L﹣1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1_____p2(选填“大于”或“小于”);当压强为p2时,在y点:v(正)______v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp=_______MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1mol•L﹣1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1_____p2(选填“大于”或“小于”);当压强为p2时,在y点:v(正)______v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp=_______MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。








