-
( I)氧化还原反应Cu+2AgNO3=Cu(NO3)2+2Ag可设计成一个原电池,写出两个电极上的电极反应:负极:______,正极:______.
(II)已知NaHCO3水溶液呈碱性:
(1)用离子方程式表示NaHCO3溶液呈碱性的原因______
(2)NaHCO3溶液中各离子的浓度由大到小的关系是______
(III)某温度下,密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
回答下列问题:物质 A B C 初始浓度/mol•L-1 0.020 0.020 平衡浓度/mol•L-1 0.016 0.016 0.0080
(1)反应达到平衡时,A的转化率为______.
(2)该反应的化学方程式可表示为(用A、B、C表示物质的化学式)______,其平衡常数为______.
(3)该温度下,若将A和B各0.10mol的气体混合物充入10L的密闭容器中发生反应,10s末达到平衡,则用A表示的化学反应速率为______.高二化学解答题中等难度题查看答案及解析
-
(16分)
(I)氧化还原反应Cu+2AgNO3=Cu(NO3)2+2Ag可设计成一个原电池,
写出两个电极上的电极反应:负极:____________,正极:_____________。
(II)已知NaHCO3水溶液呈碱性:
(1)用离子方程式表示NaHCO3溶液呈碱性的原因__________________
(2) NaHCO3溶液中各离子的浓度由大到小的关系是________________
(III)某温度下,密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
物质
A
B
C
初始浓度/mol•L—1
0.020
0.020
0
平衡浓度/mol•L—1
0.016
0.016
0.0080
回答下列问题:
(1)反应达到平衡时,A的转化率为_____________。
(2)该反应的化学方程式可表示为(用A、B、C表示物质的化学式)
_____________________________,其平衡常数为_______________。
(3)该温度下,若将A和B各0.10mol的气体混合物充入10L的密闭容器中发生反应,10s末达到平衡,则用A表示的化学反应速率为____________________。
高二化学填空题简单题查看答案及解析
-
有关电化学知识的描述正确的是
A.理论上说,任何能自发进行的氧化还原反应都可设计成原电池
B.某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥内可以是含琼脂的KCl饱和溶液
C.因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中组成原电池,铁作负极,铜作正极,其负极反应式为Fe-2e-===Fe2+
D.由Al、Mg与氢氧化钠溶液组成的原电池,其负极反应式为Mg-2e-+2OH-===Mg(OH)2
高二化学选择题简单题查看答案及解析
-
根据下式所示的氧化还原反应设计一个原电池:Cu(s)+2Ag+(aq)=Cu2+(aq)+2Ag
(1)装置可采用烧杯和盐桥,画出此原电池的装置简图
①注明电极材料和电解质溶液
②注明原电池的正极和负极
③注明外电路中电子的流向
(2)写出两个电极上的电极反应式
高二化学简答题困难题查看答案及解析
-
某原电池构造如右图所示。下列有关叙述正确的是( )
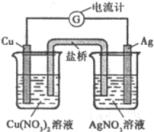
A.取出盐桥后,电流计的指针仍发生偏转
B.在外电路中,电子由银电极流向铜电极
C.原电池的总反应式为Cu+2AgNO3=2Ag+Cu(NO3)2
D.盐桥中电子的移动是从右向左
高二化学选择题中等难度题查看答案及解析
-
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池 如图所示。下列说法正确的是

A. 银电极为负极 B. X电极是锌电极
C. 去掉盐桥电流计指针仍偏转 D. Y溶液为AgNO3溶液
高二化学单选题简单题查看答案及解析
-
Cu2O可由电解制取,如图所示,电解总反应:2Cu+H2O=Cu2O+H2↑。下列说法正确的是( )

A. 该反应也可设计为原电池
B. 铜电极发生还原反应
C. 铜电极接直流电源的负极
D. 石墨电极上产生氢气
高二化学单选题中等难度题查看答案及解析
-
Cu2O可由电解制取,如图所示,电解总反应:2Cu+H2O=Cu2O+H2↑。下列说法正确的是

A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.该反应也可设计为原电池
高二化学选择题简单题查看答案及解析
-
(8分)根据下式所示的氧化还原反应设计一个原电池:Cu + 2Ag+ =Cu2+ + 2Ag
(1)装置可采用烧杯和盐桥,画出此原电池的装置简图;
(2)注明原电池的正极和负极,以及外电路中电子流向;
(3)写出两个电极上的电极反应式;
高二化学填空题简单题查看答案及解析
-
任何自发的氧化还原反应都可以设计成原电池.请你利用下列反应“Cu+2Ag+=2Ag+Cu2+”设制一个化学电池,并回答下列问题:
(1)该电池的负极材料是______,电解质溶液是__________.
(2)在外电路中,电子方向是从______极到______极.
高二化学填空题简单题查看答案及解析