-
相同温度下,容积相同的甲、乙两个恒容密闭容器中均发生如下反应:2SO2(g) + O2(g) 2SO3(g) + 197 kJ实验测得有关数据如下:
2SO3(g) + 197 kJ实验测得有关数据如下:
| 容器编号 | 起始时各物质的物质的量 / mol | 达到平衡时体系能量的变化/KJ |
| SO2 | O2 | SO3 |
| 甲 | 2 | 1 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 放出热量:Q2 |
下列判断中不正确的是
A.197>Q1>Q2
B.达到平衡时SO2的体积分数:甲>乙
C.两容器中反应的平衡常数相等
D.生成1molSO3(l)时放出的热量大于98.5kJ
-
相同温度下,容积相同的甲、乙两个恒容密闭容器中均发生如下反应:2SO2(g)+O2(g)  2SO3(g) △H=-197 kJ/mol ,实验测得有关数据如下:
2SO3(g) △H=-197 kJ/mol ,实验测得有关数据如下:
| 容器编号 | 起始时各物质的物质的量 / mol | 达到平衡时体系能量的变化/kJ |
| SO2 | O2 | SO3 |
| 甲 | 2 | 1 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 放出热量:Q2 |
下列判断中正确的是
A.两容器中反应的平衡常数不相等
B.达到平衡时SO2的体积分数:甲<乙
C.197>Q1>Q2
D.生成1molSO3(l)时放出的热量等于98.5kJ
-
相同温度下,容积相同的甲、乙两个恒容密闭容器中均发生如下反应:2SO2(g)+O2(g)  2SO3(g) △H=-197 kJ/mol ,实验测得有关数据如下:
2SO3(g) △H=-197 kJ/mol ,实验测得有关数据如下:
| 容器编号 | 起始时各物质的物质的量 / mol | 达到平衡时体系能量的变化/kJ |
| SO2 | O2 | SO3 |
| 甲 | 2 | 1 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 放出热量:Q2 |
下列判断中正确的是
A.两容器中反应的平衡常数不相等
B.达到平衡时SO2的体积分数:甲<乙
C.197>Q1>Q2
D.生成1molSO3(l)时放出的热量等于98.5kJ
-
相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:
2SO2(g)+O2(g)⇌2SO3(g)+197kJ.实验测得起始、平衡时的有关数据如下表: | 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 |
| SO2 | O2 | SO3 | Ar |
| 甲 | 2 | 1 | | | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | | 放出热量:Q2 |
| 丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
下列叙述正确的是( )
A.Q1=Q2=Q3
B.达到平衡时,丙容器中SO2的体积分数最大
C.甲、乙、丙3个容器中反应的平衡常数相等
D.若在上述条件下反应生成2molSO3(s)的反应放热小于197kJ
-
相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 |
| SO2 | O2 | SO3 | Ar |
| 甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2=78.8kJ |
| 丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
| | | | | |
下列叙述正确的是 ( )
A.Q1>Q3>Q2 =78.8kJ
B.若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)= mol/(L·min)
mol/(L·min)
C.甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50%
D.三个容器中反应的平衡常数均为K=2
-
相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:2SO2(g) + O2(g)  2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
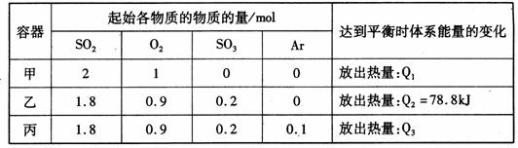
下列叙述正确的是( )
A.Q1>Q3>Q2 =78.8kJ
B.三个容器中反应的平衡常数均为K=2
C.甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50%
D.若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)= mol/(L·min)
mol/(L·min)
-
相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:
2SO2(g)+O2(g) 2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:

下列叙述正确的是
A.Q1>Q3>Q2 =78.8kJ
B.三个容器中反应的平衡常数均为K=2
C.甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50%
D.若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)= mol/(L·min)
mol/(L·min)
-
已知:2SO2(g)+O2(g) 2SO3(g) △H =-197 kJ·mol-1。在容积相同的甲、乙、丙三个容器中,保持温度、容积一定,分别按下表要求充入气体发生反应:
2SO3(g) △H =-197 kJ·mol-1。在容积相同的甲、乙、丙三个容器中,保持温度、容积一定,分别按下表要求充入气体发生反应:
| 容器 | SO2(mol) | O2(mol) | 氦气(mol) | 达平衡时实际热效应(kJ·mol-1) |
| 甲 | 2 | 1 | 0 | △Hl |
| 乙 | 1 | 0.5 | 0 | △H 2 |
| 丙 | 1 | 0.5 | l | △H 3 |
根据以上数据,下列比较正确的是
A.△H l=-197 kJ·mol-1 B.△H 2=△H3 C.△H l=2△H 2 D.△H l>△H 3
-
已知298K时反应2SO2(g)+O2(g)═2SO3(g)△H=-197kJ•mol-1,在相同温度下向一密闭容器中加入2molSO2和1molO2,达化学平衡时放出热量为a1kJ;向另一容积相同的密闭容器中通入1molSO2和0.5molO2,达化学平衡时放出热量为a2kJ,则下列关系式中正确的是( )
A. 2a2>a1>197 B. 2a2<a1<197 C. 2a2=a1>197 D. 2a2=a1=197
-
相同温度下,甲(恒容)、乙(恒压)、丙(恒容)3个密闭容器中发生可逆反应:
2SO2(g)+O2(g) 2SO3(g)ΔH = -197 kJ/mol。实验测得起始、平衡时的有关数
2SO3(g)ΔH = -197 kJ/mol。实验测得起始、平衡时的有关数
据如下表。下列正确的是
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 |
| SO2 | O2 | Ar |
| 甲 | 2 | 1 | 0 | 放出热量:Q1 |
| 乙 | 2 | 1 | 0 | 放出热量:Q2 |
| 丙 | 2 | 1 | 0.5 | 放出热量:Q3 |
A.Q1 =Q3<Q2
B.达到平衡时,乙容器中SO2的体积分数最大
C.平衡时,甲、乙、丙3个容器中甲的平衡常数最小
D.若在上述条件下,反应生成1molSO3(s),则反应放热为98.5kJ
2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
mol/(L·min)

