-
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡。请根据所学知识回答下列问题:
常温时,FeCl3的水溶液呈___(填“酸”“中”或“碱”)性,原因是___(用离子方程式表示);实验室配制0.01mol·L-1FeCl3的溶液时,为了抑制FeCl3的水解使溶液中不产生沉淀可加入少量的盐酸至溶液pH不大于___;若把配制的FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是___。(常温下Fe(OH)3的溶度积Ksp=1.0×10-38)
-
盐在化学工业中有重要的应用,请回答下列问题
(1)用离子方程式表示FeCl3可作净水剂的原因:___________________ 。
(2)常温下,在pH=3的硫酸与pH=11的Na2S溶液中,水电离出来的c(OH-)之比为_____ , 向Na2S溶液中加入AlCl3溶液时,产生白色沉淀和有臭鸡蛋味的气体,其离子方程式为:_________________。
(3)c(NH4+)相等的下列溶液① NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4
⑤NH3 H2O,溶液的物质的量浓度由小到大的顺序是__________ (用序号表示)
(4)已知t ℃时AgCl的Ksp=2×10-10 ;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列正确的是 _______
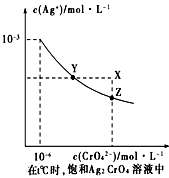
A.在t ℃时,Ag2CrO4的Ksp为1×10-9
B.t ℃时,在饱和Ag2CrO4溶液中加入K2CrO4 可使溶液由Y点到X点
C.在t ℃时,以0.01mol/L AgNO3溶液滴定20mL0.01 mol/L KCl和0.01 mol/L的K2CrO4的混合溶液,Cl-先沉淀
D.在t ℃时,AgCl的溶解度大于Ag2CrO4
(5)已知某温度时:Ksp[Fe(OH)3]=1×10-38,Ksp[Cu(OH)2]=1×10-20。在该温度下向Fe3+、Cu2+均为0.01mol•L-1的溶液中逐滴加入NaOH溶液,要Fe3+完全沉淀,而Cu2+不产生沉淀,溶液中PH应控制的范围是_______。(当离子浓度小于1×10-5mol/L时,认为完全沉淀)。
-
(12分)回答下列问题。
(一)(1)常温时,FeCl3 溶液的pH 7(填“>”、“<”或“=”),原因是(用方程式表表示) 。
(2)25℃时,向0.1 mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH减小,主要原因是 。
(3)某溶液中只存在OH-、H+、Na+、CH3COO-四种离子。
①若溶液中只溶解了一种溶质,这四种离子的浓度大小关系为: ;
②若溶液中四种离子的大小顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则溶液中溶质的化学式为 。
③若溶液中c(Na+)=c(CH3COO-),该溶液由体积相等的稀NaOH和CH3COOH溶液混合而成,则混合前c(NaOH) c(CH3COOH)(填“>”、“<”或“=”)。
(二)工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:

其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。
A.Cr2O72—和CrO42—的浓度相同
B.2v (CrO42—)= v (Cr2O72—)
C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
-
回答下列问题.
(一)(1)常温时,FeCl3 溶液的 pH _________7(填“>”、“<”或“=”),原因是(用方程式表表示) _________.
(2)25℃时,向 0.1mol•L-1 氨水中加入少量 NH4Cl 固体,当固体溶解后,测得溶液 pH减小,主要原因是__________.
(3)某溶液中只存在 OH-、H+、Na+、CH3COO-四种离子.
①若溶液中只溶解了一种溶质,这四种离子的浓度大小关系为:__________,
②若溶液中四种离子的大小顺序为 c(Na+)>c(OH﹣)>c(CH3COO﹣)>c(H+),则溶液中溶质的化学式为________.
③若溶液中 c(Na+)=c(CH3COO﹣),该溶液由体积相等的稀 NaOH 和 CH3COOH 溶液混合而成,则混合前 c(NaOH)________c(CH3COOH)(填“>”、“<”或“=”).
-
回答下列问题。
(1)常温时,FeCl3 溶液的pH___7(填“>”、“<”或“=”),原因是(用离子方程式表示________)
(2)常温时,Na2CO3溶液的pH____7(填“>”、“<”或“=”),原因是(用离子方程式表示______)
(3)用石墨作电极电解AgNO3溶液,电解一段时间后溶液的酸性_____(填“增强”、或“减弱”),阳极产物是_______,阴极产物是______,电解反应的总方程式为________;
(4)用石墨作阳极,铁作阴极电解Na2SO4溶液,电解一段时间后溶液的酸性_____(填“增强”、“减弱”或“不变”),阳极产物是_______,阴极产物是______,电解反应的总方程式为__________;
-
回答下列问题。
(1)常温时,FeCl3 溶液的pH________7(填“>”、“<”或“=”),实验室配制FeCl3溶液时常将FeCl3固体先溶于较浓的盐酸溶液中,然后再用蒸馏水稀释到所需的浓度,原因是;将FeCl3溶液蒸干、灼烧,此过程中所涉及到的化学方程式是。
(2)25℃时,向0.1 mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH减小,主要原因是________。
(3)某溶液中只存在OH-、H+、Na+、CH3COO-四种离子。
①若溶液中只溶解了一种溶质,该溶质的名称是________,该溶液中四种离子的浓度由大到小的顺序为________。
②若溶液中四种离子的大小顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则溶液中溶质的化学式为________。
③若溶液中c(Na+)=c(CH3COO-),则该溶液显________(填“酸性”、“碱性”、“中性”),该溶液由体积相等的稀NaOH和CH3COOH溶液混合而成,则混合前c(NaOH) ________ c(CH3COOH)(填“>”、“<”或“=”)。
-
盐在化学工业中有重要的应用,请回答下列问题。
(1)用离子方程式表示FeCl3可作净水剂的原因:______________________________。
(2)常温下,在pH=3的硫酸与pH =11的Na2S溶液中,水电离出来的c(OH-)之比为_______
(3)物质的量浓度相等的下列溶液①NH4Cl②NH4 HSO4③(NH4 ) 2SO4④CH3 COONH4⑤NH3 • H2O,溶液中的C(NH4 +)由大到小的顺序是__________________(用序号表示)。
(4)25℃,两种酸的电离平衡常数如下表:
| Ka1 | Ka2 |
| H2SO3 | 1.3x10-2 | 6.3x10-8 |
| H2CO3 | 4.2x10-7 | 5.6x10-11 |
①0.10 mol • L-1NaHSO3溶液中离子浓度由大到小的顺序为__________________
②向NaHCO3溶液中通入少量二氧化硫时反应的离子方程式为__________________________
(5)已知 25 ℃ 时 Ksp[Mg(OH)2] =1.8×10-11, Ksp[Cu(OH)2] =2.2 ×10-20.25 ℃时,向浓度均为0.1 mol • L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________(填化学式)沉淀;当体系中两种沉淀共存时, =_______。
=_______。
-
(1)根据氯化铁溶液回答下列问题:
①向FeCl3溶液中加入少量NaHCO3。产生的现象为___。用离子方程式表示其原因___。
②不断加热FeCl3溶液蒸干其水分并灼烧,得到的固体是___。
③在配制FeCl3溶液时,为防止溶液变浑浊,应加入___。
(2)利用反应Cu+H2O2+H2SO4=CuSO4+2H2O设计一个原电池,回答下列问题:
①负极材料为___;正极反应式为___。
②反应过程中SO 向____极移动。
向____极移动。
③当电路中转移0.1mol电子时,电解液质量(不含电极)增加了___克。
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
①物质的量浓度均为0.1mol•L-1的四种溶液:pH由小到大排列的顺序是__(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是___(填字母)
A.c(H+) B. C.c(H+)•c(OH-) D.
C.c(H+)•c(OH-) D. E.
E.
③写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:____。
④25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=____(填准确数值)。
⑤标准状况下,将1.12LCO2通入100mL1mol•L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:c(OH-)=2c(H2CO3)+____。
-
铁是地球上分布最广、最常用的金属之一。请回答下列关于Fe元素的问题:
(1) FeCl3溶液显酸性,其原因是(用离子方程式表示)________________________。
不断加热FeCl3溶液时,蒸干其水分并灼烧得到的固体是______________________。
(2)在配制FeCl3溶液时,为防止浑浊,应加入_______________。
(3)向FeCl3溶液中加入少量NaHCO3浓溶液,预计可能看到的现象是________________。
-
(8分)(1)FeCl3的水溶液呈 (“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): 。
(2)实验室在配制 FeCl3的溶液时,常将FeCl3固体先溶于 中,然后再用蒸馏水稀释到所需的浓度。
(3)把FeCl3溶液蒸干,灼烧,最后得到的主要产物是 。
(4)普通泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒中盛碳酸氢钠溶液,其化学反应的原理是(用离子方程式解释) 。碳酸氢钠溶液中的电荷守恒式为 ,溶液中离子浓度由大到小的顺序为 。

Cr2O72—(橙色)+H2O
