-
Ⅰ、实验室常用MnO2与浓盐酸反应制备Cl2(MnO2+4HCl(浓)→MnCl2+Cl2↑+2H2O反应装置如图所示)。
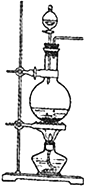
(1)装置图中的主要玻璃仪器有酒精灯、________、__________等。产生的氯气通入水中制得氯水备用。氯水含有的离子除H+、Cl-外还有___________等离子,氯水中因含有__________而具有漂白性。
Ⅱ、某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:

请根据上面流程,回答以下问题:
(2)样品溶解时加盐酸的作用是___________________________________。加入氯水所发生反应的离子方程式___________________________________。
(3)证明Fe3+离子已经沉淀完全的操作是___________________________________。将沉淀物加热灼烧过程中,为使实验结果准确,必须的操作为___________________。
(4)若原样品质量a 为40.00g,加热后红棕色固体质量b为2.200g,则样品中铁元素的质量分数是_________;若称量准确,最终测量的结果偏大,则造成误差的原因可能是_____________(写出一种原因即可)。
-
实验室制备Cl2通常采用下列反应:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O;据此,从如图所示仪器装置中选择制备并收集干燥、纯净Cl2的装置是( )
MnCl2+Cl2↑+2H2O;据此,从如图所示仪器装置中选择制备并收集干燥、纯净Cl2的装置是( )
A.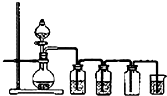
B.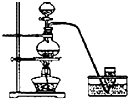
C.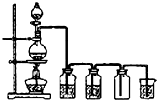
D.
-
实验室常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O.
MnCl2+Cl2↑+2H2O.
(1)写出该反应的离子方程式______ Mn2++Cl2↑+2H2O
-
(1)实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。请回答下列问题:
MnCl2+Cl2↑+2H2O,取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。请回答下列问题:
①写出该反应的离子反应方程式________________,
②反应中被氧化的HCl的物质的量为________mol。
③实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸的物质的量浓度_________ molL-1。
(2)把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1 molL-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。
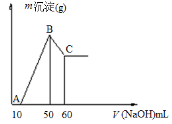
①合金中镁的质量g。
②盐酸的物质的量浓度molL-1
-
实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4L.
请回答下列问题:
(1)该反应的离子方程式为______ Cl2↑+Mn2++2H2O
-
(6分)实验室常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)写出该反应的离子方程式___________________________________________。
(2)在反应中MnO2发生________(填“氧化”或“还原”)反应,Cl2是________(同上)产物。
(3)当0.1 mol MnO2参加反应时,转移电子数为________,被氧化的HCl为________ mol。
-
某小组在实验室使用软锰矿(主要成分为MnO2)和浓盐酸通过加热制备制备氯气,化学方程式为:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O。并对氯气的性质进行探究。
(1)氯气制备:
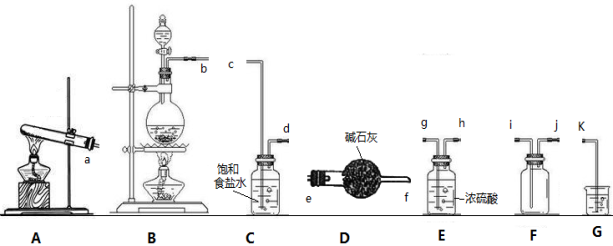
①欲收集一瓶干燥的氯气,请按接口序号完成“制取→收集”的连接顺序为:
→ c → d → → → i → j → k
②制备氯气也可用高锰酸钾固体和浓盐酸在常温下制得,其化学方程式为:
□KMnO4 + □HCl(浓) → □MnCl2 + □Cl2↑ + □KCl + □
请配平上述化学方程式。
③请写出仪器G中可能反应的离子方程式为
(2)性质检验:将氯气溶于水后,进行实验检测。所用试剂有:0.01mol/LAgNO3溶液、紫色石蕊试液。
| 操作步骤 | 实验现象 | 解释原因 |
| 
① | 滴加 ,现象有: | 原因有: |
| 
② | 滴加 ,现象有: | 原因有: |
-
某化学小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:
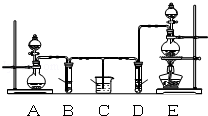
(1)他们制备Cl2依据的原理是:MnO2+4HCl(浓)△MnCl2+2H2O+Cl2↑,应选用图A、E装置中的 (填序号)制Cl2,反应中浓盐酸所表现出的性质是 、 .
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是 .
(3)写出过量NaOH溶液与SO2气体反应的离子方程式是 .
(4)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色.查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是 .
-
(12分)某化学小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:
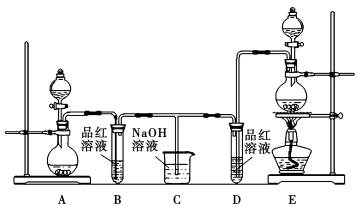
(1)他们制备Cl2依据的原理是:MnO2+4HCl(浓)  MnCl2+2H2O+Cl2↑,应选用上图A、E装置中的______________(填序号)制Cl2,反应中浓盐酸所表现出的性质是__________________。
MnCl2+2H2O+Cl2↑,应选用上图A、E装置中的______________(填序号)制Cl2,反应中浓盐酸所表现出的性质是__________________。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是________________________________。
(3)NaOH溶液分别与两种气体反应的离子方程式是
______________________________________________________
________________________________________________。
(4)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1∶1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是____________________________。
-
某化学小组为了证明SO2和Cl2的漂白性,设计了如下图所示的实验装置:
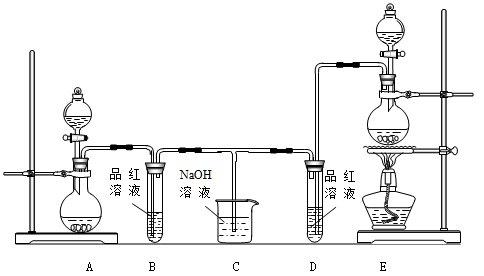
(1)他们制备Cl2依据的原理是:MnO2 + 4HCl(浓) MnCl2 + 2H2O + Cl2↑,应选用上图A、E装置中的 (填序号)制Cl2,反应中浓盐酸所表现出的性质是 、 。
MnCl2 + 2H2O + Cl2↑,应选用上图A、E装置中的 (填序号)制Cl2,反应中浓盐酸所表现出的性质是 、 。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是 。
(3)NaOH溶液分别与两种气体反应的离子方程式是 、 。
(4)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是 。










