-
甲烷、氢气和一氧化碳均是化工原料和重要能源。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol
2H2(g)+O2(g)=2H2O(l) △H=-570kJ/mol
则CH4(g)+2H2O(l)  CO2(g)+4H2(g)△H=-________kJ/mol
CO2(g)+4H2(g)△H=-________kJ/mol
(2)光气(COCl2)是生产农药、医药、聚酯类材料的原料。工业上制备光气的原理如下:Cl2(g)+CO(g) COCl2(g) △H,向密闭容器中充入1mol Cl2(g)和1mol CO(g),反应速率随温度的变化入图A所示,CO的平衡转化率α(CO)随压强、投料比
COCl2(g) △H,向密闭容器中充入1mol Cl2(g)和1mol CO(g),反应速率随温度的变化入图A所示,CO的平衡转化率α(CO)随压强、投料比 的变化如图B所示。
的变化如图B所示。
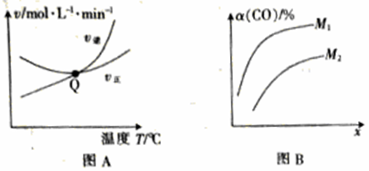
①图A中Q点的含义是________,△H________(填“>”或“<”)0。
②x代表________;M1、M2中较大的是________。
③某温度下,测定平衡体系中c(COCl2)=0.80mol/L,c(Cl2)=0.20mol/L,平衡时,CO的体积分数为________,在该温度下,反应的平衡常数K为________。
-
甲烷是一种重要的化工原料和清洁能源,研究其再生及合理利用有重要意义。
请回答:
(1)已知一定条件下发生如下反应:
CO2(g)+2H2O(g) CH4(g)+2O2(g) △H=+802kJ·mol-1。
CH4(g)+2O2(g) △H=+802kJ·mol-1。
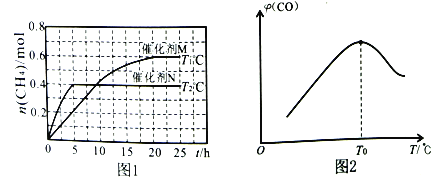
将一定量的CO2(g)和H2O(g)充入10L密闭容器中,分别在催化剂M、N的作用下发生上述反应,CH4(g)的产量(n)与光照时间(t)和温度(T)变化的关系如图1所示。
①若甲烷的燃烧热(△H)为-890kJ·mol-1,则水的汽化热△H=___________。(汽化热指1mol液体转化为气体时吸收的热量)
②T1℃、催化剂M作用下,0~20h内该反应速率v(H2O)=___________。

③根据图1判断,T1___________T2(填“>”“<”或“=”),理由为___________。
催化剂的催化效果:M___________N(填“强于”或“弱于”)。
(2)甲烷可用于制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(
CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数( )与温度(T)的关系如图2所示。
)与温度(T)的关系如图2所示。
①T0℃时,CO的体积分数最大的原因为_________________________________。
②若T0℃时,容器内起始压强为p0,CO的平衡体积分数为10%,则反应的平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
-
甲烷是一种重要的化工原料和清洁能源,研究其再生及合理利用有重要意义。
请回答:
(1)已知一定条件下发生如下反应:
CO2(g)+2H2O(g) CH4(g)+2O2(g) △H=+802kJ·mol-1。
CH4(g)+2O2(g) △H=+802kJ·mol-1。
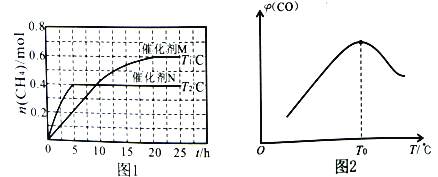
将一定量的CO2(g)和H2O(g)充入10L密闭容器中,分别在催化剂M、N的作用下发生上述反应,CH4(g)的产量(n)与光照时间(t)和温度(T)变化的关系如图1所示。
①若甲烷的燃烧热(△H)为-890kJ·mol-1,则水的汽化热△H=___________。(汽化热指1mol液体转化为气体时吸收的热量)
②T1℃、催化剂M作用下,0~20h内该反应速率v(H2O)=___________。
③根据图1判断,T1___________T2(填“>”“<”或“=”),理由为___________。
催化剂的催化效果:M___________N(填“强于”或“弱于”)。
(2)甲烷可用于制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(
CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数( )与温度(T)的关系如图2所示。
)与温度(T)的关系如图2所示。
①T0℃时,CO的体积分数最大的原因为_________________________________。
②若T0℃时,容器内起始压强为p0,CO的平衡体积分数为10%,则反应的平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
-
甲烷是一种重要的化工原料和清洁能源,研究其再生及合理利用有重要意义。
请回答:
(1)已知一定条件下发生如下反应:
CO2(g)+2H2O(g) CH4(g)+2O2(g) △H=+802kJ·mol-1。
CH4(g)+2O2(g) △H=+802kJ·mol-1。
将一定量的CO2(g)和H2O(g)充入10L密闭容器中,分别在催化剂M、N的作用下发生上述反应,CH4(g)的产量(n)与光照时间(t)和温度(T)变化的关系如图1所示。
①若甲烷的燃烧热(△H)为-890kJ·mol-1,则水的汽化热△H=___________。(汽化热指1mol液体转化为气体时吸收的热量)
②T1℃、催化剂M作用下,0~20h内该反应速率v(H2O)=___________。
③根据图1判断,T1___________T2(填“>”“<”或“=”),理由为___________。
催化剂的催化效果:M___________N(填“强于”或“弱于”)。
(2)甲烷可用于制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(
CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数( )与温度(T)的关系如图2所示。
)与温度(T)的关系如图2所示。
①T0℃时,CO的体积分数最大的原因为_________________________________。
②若T0℃时,容器内起始压强为p0,CO的平衡体积分数为10%,则反应的平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
-
天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)已知: CO(g)+H2O(g) H2(g)+CO2(g) △H=-41kJ·mol-1
H2(g)+CO2(g) △H=-41kJ·mol-1
C(s)+2H2(g) CH4(g) △H=-73kJ·mol-1
CH4(g) △H=-73kJ·mol-1
2CO(g) C(s)+CO2(g) △H=-171kJ·mol-1
C(s)+CO2(g) △H=-171kJ·mol-1
工业上可用煤制天然气,生产过程中有多种途径生成CH4。写出CO与H2反应生成CH4和H2O的热化学方程式 。
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
(3)用天然气制取H2的原理为:CO2(g)+CH4(g) 2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1 P2(填“大于”或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于”、“小于”或“等于”)。 求Y点对应温度下的该反应的平衡常数K= 。
2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1 P2(填“大于”或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于”、“小于”或“等于”)。 求Y点对应温度下的该反应的平衡常数K= 。
(计算结果保留两位有效数字)
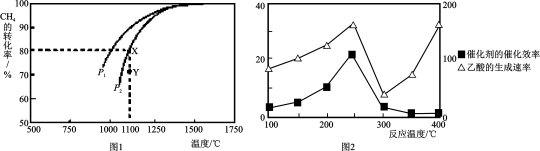
(4)以二氧化钛表面覆盖CuAl2O4 为催化剂,可以将CH4 和CO2直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。
②为了提高该反应中CH4的转化率,可以采取的措施是 。
-
氢气是新型能源和重要化工原料。
已知:①2CO(g)+O2(g)=2CO2(g)△H1
②CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2
③H2(g)+  O2(g)=H2O(l)△H2
O2(g)=H2O(l)△H2
(1)科学家提出一种利用天然气制备氢气的方法:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H,△H=__________,这种方法的推广与使用,不仅实现资源综合利用,而且还能解决环境问题是__________。
(2)氨气是重要化工原料,在国民经济中占重要地位。
①在恒温、容积相等的恒容密闭容器中投入一定量氮气、氢气,发生如下可逆反应:
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1
实验测得起始、平衡时的有关数据如表所示:
| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 |
| H2 | N2 | NH3 |
| Ⅰ | 3n | n | 0 | 放出热量a kJ |
| Ⅱ | 3n | 2n | 0 | 放出热量b kJ |
| Ⅲ | 6n | 2n | 0 | 放出热量c kJ |
| | | | |
下列判断正确的是__________。
A.N2的转化率:Ⅱ>I>Ⅲ
B.放出热量:a<b<92.4n
C.达到平衡时氨气的体积分数:Ⅲ>Ⅰ
D.平衡常数:Ⅲ>Ⅱ>Ⅰ
②在密闭恒容容器中投入一定量氮气和氢气,混合气体中氨气体积分数和温度关系如图所示:
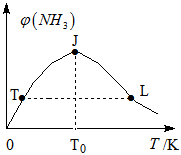
曲线TJ段变化主要原因是__________,JL段变化的主要原因是__________,氨气正反应速率:T点__________L点(填:大于、小于或等于)。
③在2L密闭容器中充入一定量的氨气,氨气的物质的量与反应时间关系如表所示:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | … |
| NH3/mol | 2 | 1.0 | 0.5 | 0.25 | 0.24 | 0.24 | |
在该条件下,前5分钟H2平均反应速率为__________。
④常温下,在V mL的a mol•L-1稀硫酸溶液中滴加b mol•L-1稀氨水V mL恰好使混合溶液呈中性.此时,一水合氨的电离常数Kb=__________(用含a、b代数式表示)。
(3)氢气直接作燃料电池的理论输出电压为1.2V,能量密度E=__________(列式计算,精确到小数点后一位。提示:能量密度=电池输出电能/燃料质量,1kW·h=3.6×106J,常用单位为kW·h·kg-1)。
-
氢气既是最理想的能源又是重要的化工原料,用甲烷制氢气是一种廉价的制氢方法。有关的热化学方程式如下:
①CH4(g)+ O2(g)
O2(g) CO(g)+2H2(g) ΔH<0
CO(g)+2H2(g) ΔH<0
②CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0
CO(g)+3H2(g) ΔH>0
下列说法不正确的是( )
A.当反应①中v(CH4)正=v(CO)逆时,表明该反应达平衡状态
B.其他条件不变时,增大体系压强,反应①、②中甲烷的转化率均减小
C.使用高效催化剂可以加快反应速率,同时提高CH4的转化率
D.同一容器内同时发生反应①与②时,容器内温度可能保持不变
-
氢气是一种清洁能源,又是合成氨工业的重要原料。
(1)已知:CH4(g)+H2O==CO+3H2(g) △H=206.2 kJ·mol-1。
CH4(g)+CO2(g)==2CO(g)+2H2(g) △H=247.4 kJ·mol-1
甲烷和H2O(g)反应生成H2和CO2的热化学方程式为___________________。
(2)工业合成氨的反应原理为N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ·mol-1。
2NH3(g) △H=-92.4 kJ·mol-1。
某温度下,把10 mol N2与28 mol H2置于容积为10 L的密闭容器内,10 min时反应达到平衡状态,测 得氮气的平衡转化率为60%,则10 min内该反应的平均速率v(NH3)=__________mol·L-1·min-1,该温度下该反应的平衡常数K=________。 欲增大氮气的平衡转化率,可采取的措施有_____________、____________等(共写两条措施即可,每空一条)。
(3)下图所示装置工作时均与H2有关。
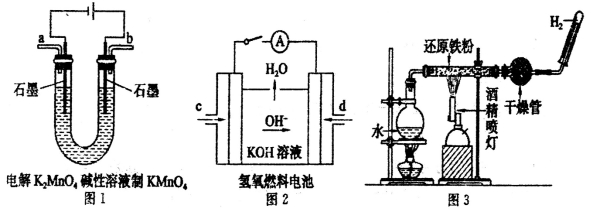
图l所示装置中阳极的电极反应式为______________。
②图2所示装置中,通入H2的管口是_____________(选填字母代号)。
③某同学按图3所示装置进行实验,实验结束后.将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液。溶液不变红,再滴入新制氯水,溶液变为红色。该同学据此得出结论:铁与水蒸气反应生成FeO和H2。该结论_____________(填“严密”或“不严密”),你的理由是(用离子方程式和必要的文字说明)______________________。
-
甲烷自热氧化重整是工业上获得氢气的重要方法,其反应为:
2CH4(g)+O2(g)=2CO(g)+4H2(g) △H=akJ/mol。
(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=bkJ/mol
②CH4(g)+CO2(g)=2CO(g)+2H2(g) △H2
③CH4(g)+H2O(g)=CO(g)+3H2(g) △H3=ckJ/mol。
则△H2=___________kJ/mol(用含a、b、c的代数式表示)。
(2)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)=CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。图1为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。CO的平衡转化率在不同压强下随温度的变化如图2所示。
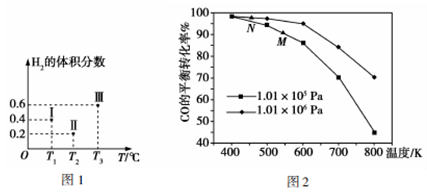
①0~5min时间内容器II中用CH3OH表示的反应速率为___________。
②三个容器中一定达到平衡状态的是容器________。
③当三个容器中的反应均达到平衡状态时,CO的转化率最低的是容器______。
④平衡常数最大的是容器__________。
⑤工业实际合成CH3OH生产中,常用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由:______________。
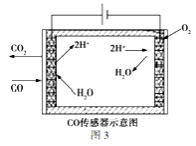
(3)合成甲醇尾气中CO的浓度常用电化学气敏传感器进行测量,其中CO传感器可用图3简单表示,则阳极发生的电极反应为_______________。
-
氢气是一种清洁能源,又是合成氨工业的重要原料.
(1)已知:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ/mol
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4kJ/mol
甲烷和H2O(g)反应生成H2和CO2的热化学方程式为______.
(2)工业合成氨的原理为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol.
某温度下,把10mol N2与28mol H2置于容积为10L的密闭容器内,10min时反应达到平衡状态,测得氮气的平衡转化率为60%,则10min内的平均反应速率v(H2)=______mol/,该温度下该反应的平衡常数K=______.
欲增大氮气的平衡转化率,可采取的措施有______(写一种措施即可).
(3)图所示装置工作时均与H2有关.
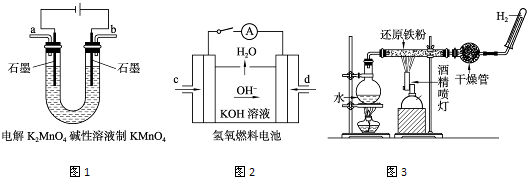
①图1所示装置中阳极的电极反应式为______.
②图2所示装置中,通入H2的管口是______(选填字母代号).
③某同学按图3所示装置进行实验,实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色.该同学据此得出结论:铁与水蒸气反应生成FeO和H2.该结论______(填“严密”或“不严密”),你的理由是______(用离子方程式表示).
CO2(g)+4H2(g)△H=-________kJ/mol
COCl2(g) △H,向密闭容器中充入1mol Cl2(g)和1mol CO(g),反应速率随温度的变化入图A所示,CO的平衡转化率α(CO)随压强、投料比
的变化如图B所示。









