-
为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
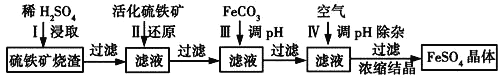
活化硫铁矿的主要成份是FeS2。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是_______________________________。
(2)第Ⅱ步中硫铁矿中的S被氧化到最高价态,相应的离子方程式为______________________。
(3)第Ⅱ步中检验Fe3+是否被完全还原的实验方法是____________________________________。
(4)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质被除尽。通入空气引起溶液pH降低的原因是_________________________。
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2===Fe+2Li2S,正极反应式是________________。
-
(16分)为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
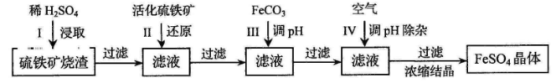
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择 (填字母编号)。
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是 。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s) + 3O2 (g) =2Fe2O3(s)  =-1648kJ/mol
=-1648kJ/mol
C(s)+O2(g)=CO2(g)  =-393kJ/mol
=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)  =-1480kJ/mol
=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2= Fe +2Li2S,正极反应式是 。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为50%。将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取,铁的浸取率为96%,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3 kg。
-
为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略去)。
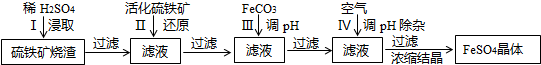
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(S04)3+8H2O═15FeSO4+8H2SO4,不考虑其它反应,请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是________________________;
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择_____________(填字母编号).
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液PH到5.8左右,然后在第Ⅳ步通入空气使溶液pH到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质被除尽,通入空气引起溶液pH降低的原因是___________________;
(4)FeSO4可转化FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料.
已知25℃,101kPa时:
4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol
C(s)+O2(g)═CO2(g)△H=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是___________________;
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料.该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2═Fe+2Li2S,正极反应式是_________________;
(6)假如烧渣中的铁全部视为Fe2O3,其含量为50%.将akg质量分数为b%的硫酸加入到ckg烧渣中浸取,铁的浸取率为96%,其它杂质浸出消耗的硫酸以及调pH后溶液呈微酸性,所残留的硫酸忽略不计,按上述流程,第Ⅲ步应加入FeCO3____________Kg。
-
为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
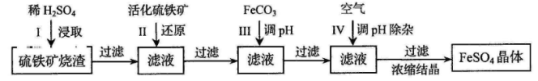
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择 (填字母编号)。
A.KMnO4溶液 B.淀粉-KI溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是 。
(4)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2= Fe +2Li2S,正极反应式是 。
(5)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s) + 3O2 (g) =2Fe2O3(s)  =-1648kJ/mol
=-1648kJ/mol
C(s)+O2(g)=CO2(g)  =-392kJ/mol
=-392kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)  =-1480kJ/mol
=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为p。将b kg质量分数为c的硫酸加入到a kg烧渣中浸取,铁的浸取率为q,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3 kg。
-
为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
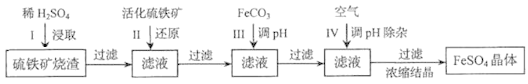
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是_____________________。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择_________________(填字母编号)。
A.KMnO4溶液 B.淀粉-KI溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是_______________。
(4)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2=Fe+2Li2S,正极反应式是___________。
(5)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s)+ 3O2 (g)=2Fe2O3(s)∆H=-1648kJ/mol
C(s)+O2(g)=CO2(g)∆H =-392kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)∆H =-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是______________。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为p。将b kg质量分数为c的硫酸加入到a kg烧渣中浸取,铁的浸取率为q,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3___________kg。
-
为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
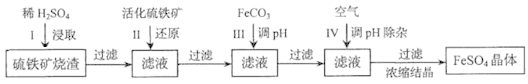
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是_____________________。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择_________________(填字母编号)。
A.KMnO4溶液 B.淀粉-KI溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是_______________。
(4)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2=Fe+2Li2S,正极反应式是___________。
(5)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s)+ 3O2 (g)=2Fe2O3(s)∆H=-1648kJ/mol
C(s)+O2(g)=CO2(g)∆H =-392kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)∆H =-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是______________。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为p。将b kg质量分数为c的硫酸加入到a kg烧渣中浸取,铁的浸取率为q,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3___________kg。
-
为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
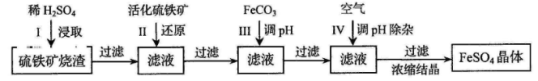
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择 (填字母编号)。
A.KMnO4溶液 B.淀粉-KI溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是 。
(4)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2= Fe +2Li2S,正极反应式是 。
(5)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s)+ 3O2 (g)=2Fe2O3(s)  =-1648kJ/mol
=-1648kJ/mol
C(s)+O2(g)=CO2(g)  =-392kJ/mol
=-392kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)  =-1480kJ/mol
=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为p。将b kg质量分数为c的硫酸加入到a kg烧渣中浸取,铁的浸取率为q,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3 kg。
-
为了保护坏境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(Fe主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略).
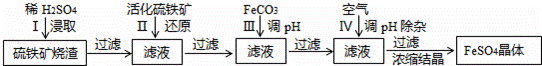
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(S04)3+8H2O=15FeSO4+8H2SO4,不考虑其它反应,请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 .
(2)检验第Ⅱ步中Fe3+是否完全被还原,应选择 (填字母编号).
A.KMnO4溶液 B.KCl溶液 C.KSCN 溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质被除尽,通入空气引起溶液pH降低的原因是
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料.
已知25℃,101kPa时:
4Fe(s)+3O2(g)═2Fe2O3(s)△H=﹣1648kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393kJ/mol
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=﹣1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2=Fe+2Li2S,正极反应式是
(6)假如烧渣中的铁全部视为Fe2O3,其含量为50%,将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取,铁的浸取率为96%,其它杂质浸出消耗的硫酸以及调pH后溶液呈微酸性,所残留的硫酸忽略不计,按上述流程,第Ⅲ步应加入FeCO3 kg.
-
为了保护坏境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(Fe主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
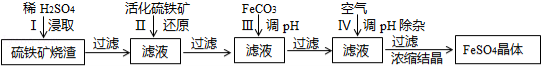
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(S04)3+8H2O=15FeSO4+8H2SO4,不考虑其它反应,请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第Ⅱ步中Fe3+是否完全被还原,应选择 (填字母编号)。
A.KMnO4溶液 B.KCl溶液 C.KSCN 溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质被除尽,通入空气引起溶液pH降低的原因是 。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s)△H=﹣1648kJ/mol
C(s)+O2(g)=CO2(g)△H=﹣393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)△H=﹣1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2=Fe+2Li2S,正极反应式是 。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为50%,将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取,铁的浸取率为96%,其它杂质浸出消耗的硫酸以及调pH后溶液呈微酸性,所残留的硫酸忽略不计,按上述流程,第Ⅲ步应加入FeCO3 kg
-
为了保护环境,充分利用资源,某研究小组通过如下简化流程,利用回收的某酸性锌锰干电池,处理可得到多种化工原料,并制备ZnSO4·7H2O。经查询该电池一种一次性电池,外壳为金属锌铁合金,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的填充物,放电过程产生MnOOH。
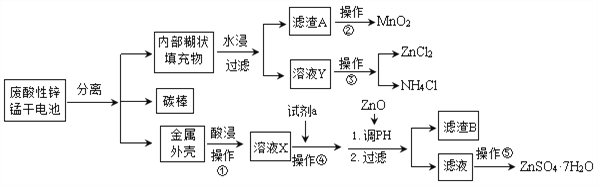
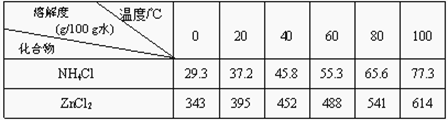
已知:Ksp(Zn(OH)2)=10-17;Ksp(Fe(OH)3)=10-39;
 = 4.64 lg2 = 0.3
= 4.64 lg2 = 0.3
回答下列问题:
(1)操作①的酸浸选用的酸为__________(填化学式),溶液X含有的阳离子为_________。
(2)滤渣A进行操作②得到较纯的MnO2,最简便的方法为__________,其原理是________。
(3)操作③和操作⑤,可通过__________、过滤、洗涤、晾干等步骤,分离提纯得到产品。
(4)操作④选用的试剂a选用___________(填化学式),其目的是______________________________(用离子方程式表示),继续加 ZnO调节pH,生成氢氧化铁沉淀,铁刚好沉淀完全的pH约为________ (离子浓度小于1×10-5 mol·L-1时,即可认为该离子沉淀完全)。










