-
(1)在298K时,1molCH4在氧气中完全燃烧生成二氧化碳和液态水,放出热量890.0 kJ。写出该反应的热化学方程式________。现有CH4和CO的混合气体0.75mol,完全燃烧后,生成CO2气体和18克液态水,并放出515kJ热量,则CH4和CO的物质的量分别为________、________mol.
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入甲烷和氧气。通入甲烷气体的电极应为________极(填写“正”或“负”),该电极上发生的电极反应是 (填字母代号)。
a. CH4—e- + 2O2 == CO2 + 2H2O
b. CH4—8e- + 10OH- == CO32- + 7H2O
c. O2 + 2H2O + 4 e- == 4OH-
d. O2—4 e- + 4H+ == 2H2O
(3)在如图所示实验装置中,石墨棒上的电极反应式为________;如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是;若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入________(填物质名称),其质量约为________。
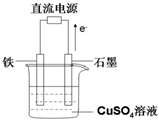
-
(10分)(1)在298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水放出热量,1558.3 kJ。写出该反应的热化学方程式________。
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入乙烷和氧气。通入乙烷气体的电极应为________极(填写“正”“负”)该电极上发生的电极反应式是________
(3)右图所示实验装置中,石墨棒上的电极反应式为________;如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入__________(填物质名称)。

-
(10分)(1)在298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水放出热量1558.3 kJ。写出该反应的热化学方程式________。
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入乙烷和氧气。通入乙烷气体的电极应为________极(填写“正”“负”)该电极上发生的电极反应式是________。
(3)右图所示实验装置中,石墨棒上的电极反应式为________;如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入__________(填物质名称)。

-
(1)在298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水放出热量1558.3kJ.写出该反应的热化学方程式______.
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入乙烷和氧气.通入乙烷气体的电极应为______极(填写“正”“负”)该电极上发生的电极反应式是______
(3)如图所示实验装置中,石墨棒上的电极反应式为______;如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入______(填物质名称).
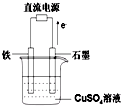
-
(16分)(1)在298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1558.3 kJ。写出该反应的热化学方程式________。若C2H6和氧气以KOH溶液组成燃料电池,其负极反应式为________。
(2) A、B、C、D、E、F六种短周期元素的原子序数依次增大。已知A、C、F三原子的最外层共有11个电子,且这种三元素的最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。试回答:
①写出下列元素的符号A ________ ,D ________ 。
②用电子式表示B、F形成的化合物为 ________ 。
③ A、C两种元素最高价氧化物的水化物之间反应的离子方程式为 ________。
④ D的固态氧化物是 ________ 晶体。含nmolD的氧化物的晶体中含D—O共价键为 ________ mol。
-
(1)在298K时,1mol C2H6 在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ。写出该反应的热化学方程式。
(2)利用该反应设计一个燃料电池:用KOH溶液作电解质溶液,多孔石墨作电极,在电极上分别通入乙烷和氧气。通入乙烷气体的电极应为________极(填“正”或“负”),该电极上发生的电极反应式为________。
(3)在右图所示实验装置中,石墨棒上的电极反应式为________。如果起始时盛有1L pH=5的CuSO4溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是________。若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入________(填物质名称),其质量约为________。
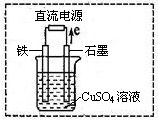
(4)将普通碳钢钉放入“84消毒液”(NaClO溶液)中浸泡一段时间。预期的实验现象是。
(5)为了进一步探究碳钢钉在该消毒液(NaClO)中的腐蚀原理,某同学设计了如图所示实验装置,写出碳(C)极上发生的电极反应式________。

-
实验测得4g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出90.8 kJ的热量。试写出甲醇燃烧热的热化学方程式________。
-
沼气是一种清洁能源,已知0.5molCH4完全燃烧生成二氧化碳和水时,放出445kJ热量,则1molCH4完全燃烧时,断裂反应物分子内的化学键所吸收的总能量与形成生成物分子内的化学键所放出的总能量之间的关系为( )
A.前者比后者多890kJ
B.后者比前者多890kJ
C.前者比后者多445kJ
D.后者比前者多445kJ
-
(1)在常温下,0.5mol甲醇在氧气中完全燃烧生成CO2和液态水,放出热量363.3kJ.写出该反应的热化学方程式: _________________________
(2)请设计一个燃料电池:电解质为强碱溶液,Pt作电极,在电极上分别通入甲醇和氧气。通入甲醇的电极应为 极(填“正”或“负”),该电极上发生的电极反应式为 。
(3)用Pt电极电解盛有1L pH=6的硝酸银溶液,如图甲所示,则右边电极上发生的电极反应式为 .

(4)某化学学习兴趣小组为了研究金属的腐蚀现象,将一枚铁钉放在“84”消毒液(NaClO)中,某同学设计了如图乙所示实验装置,写出石墨极上发生的电极反应式:
-
(1)某反应过程中的能量变化如图所示:
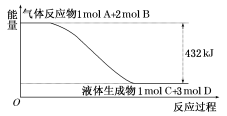
写出该反应的热化学方程式: 。
(2)0.3 mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ的热量,其热化学方程式为 。







