-
W、X、Y、Z、M、G五种短周期元素,原子序数依次增大。W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2,MY3两种分子;X的气态氢化物水溶液呈碱性。请回答下列问题:
(1)Y在元素周期表中的位置为___________;
(2) W、Y、Z、G形成的简单离子的半径大小顺序是___________(用化学符号表示)
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有________ (任写两个)
(4)ZW的电子式为___________,W2Y2的电子式为______
(5)MY2和G2均能使品红溶液褪色,常温常压下若将相同体积的MY2和G2气体同时通入品红溶液,请用相关离子方程式解释原因________。
(6)已知
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是是___________ ;制铝时,电解Al2O3而不电解AlCl3的原因是___________ 。
(7)最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N≡N放出942kJ热量。根据以上信息和数据,下列说法正确的是___________ 。
A.N4属于一种新型化合物 B.N4晶体熔点高,硬度大
C.相同质量的N4的能量高于N2 D.1molN4转变为N2将吸收882kJ的能量
-
(12分)X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。回答下列问题:
⑴ Y在元素周期表中的位置为________________。
⑵ 上述元素的最高价氧化物对应的水化物酸性最强的是_______________(写化学式),非金属气态氢化物还原性最强的是__________________(写化学式)。
⑶ Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___________(写出其中两种物质的化学式)。
⑷ X2M的燃烧热ΔH = -a kJ·mol-1 ,写出X2M燃烧反应的热化学方程式:___________。
⑸ ZX的电子式为___________;ZX与水反应放出气体的化学方程式__________________。
-
(6分)X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为 。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是 (写化学式),非金属气态氢化物还原性最强的是 (写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有______________(写出其中两种物质的化学式)。
(4)ZX的电子式为 。
-
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为______。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是______(写化学式),
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有______(写出其中两种物质的化学式)。
(4)ZX的电子式为______;ZX与水反应放出气体的化学方程式为________________________________________________________________________。
-
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
(1)Y在元素周期表中的位置为_________;
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_________(写化学式)。
(3)X、Y、Z、M组成两种盐的溶液反应可产生MY2气体,写出其反应离子方程式:_________;
(4)M的氧化物与G的单质的水溶液均有漂白性,相同条件下,相同体积的该M的氧化物与Y的单质混合通入品红溶液,品红溶液_________(填褪色或不褪色),原因(用化学方程式表示)_________。
-
A、B、C、D、E都是短周期主族元素,原子序数依次增大,B、C同周期,A、D同主族。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,E元素形成的简单离子是同周期元素中离子半径最小的。根据以上信息回答下列问题:
(1)甲、乙两分子中含有非极性共价键的物质的电子式是__________________,C元素在周期表中的位置是_________________________;
(2)C和D的离子中,半径较小的是_____________;(填离子符号)。
(3)将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的离子方程式是______________________________________________________;
(4)C、D、E可组成离子化合物DxEC6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是___________________。
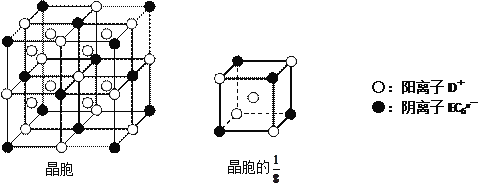
-
W、X、Y、Z是原子序数依次增大的四种短周期元素,分属于连续的四个主族,电子层数之和为10,四种原子中X原子的半径最大,下列说法不正确的是
A. Y原子形成的离子是同周期元素所形成的离子中半径最小的
B. Y的最高价氧化物不能与Z的最高价氧化物对应的水化物反应
C. W与同主族元素可以形成离子化合物
D. 工业上获得X单质可利用电解其熔融的氧化物的方法
-
A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E 同处另一周期。C、B可按原子个数比2 :1和1:1分别形成两种离子化合物甲和乙。D、A按原子个数比3 :2形成离子化合物丙。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)B元素在周期表中的位置是_____________,乙物质的电子式是______________________。
(2)A、B、C、D、E 五种元素的原子半径由小到大的顺序是____________(用元素符号填写)
(3)E 的单质与C 的最高价氧化物对应的水化物的溶液发生反应的离子方程式是______________________________________。
(4)元素A的原子核外共有_____种形状不同的电子云。
(5)含有元素C的盐的焰色反应为________________色,许多金属盐都可以发生焰色反应,其原因是________________________________________________________。
-
X、Y、Z、W是短周期主族元素,且原子序数依次增大,X元素的周期序数等于其主族序数,且X为同主族元素中唯一非金属元素,Y元素的单质是一种强力漂白剂,Z元素形成的简单离子是同周期半径最小的离子,含元素W的一种化合物是木材防火剂的原料,下列叙述错误的是( )
A.上述四种元素的原子半径大小:Z>W>Y>X
B.Z的氢氧化物和NaHCO3均可中和过多的胃酸
C.X与Y只形成既含极性共价键又含非极性共价键的共价化合物
D.W与Y形成的化合物既是建筑材料,也是工艺品(玛瑙等)的原料
-
已知 A、B、C、D、E 五种主族元素分属三个短周期,且原子序数依次增大。A、C 同主族,可形成离子化合物 CA;B、D 同主族,可形成 DB2、DB3 两种分子。请回答下列问题:
(1)五种元素原子半径由小到大的顺序为_______________(用元素符号回答)。
(2)A、B 两种元素能形成既含极性键又含非极性键的化合物 M,M 的电子式为_______________。
(3)非金属性强弱:D_______________E(填“>”“<”),用离子方程式表示__________________________。
(4)写出均由 A、B、C、D 四种元素组成的两物质的浓溶液发生反应的离子方程式_____________________________。

