-
ⅥA族元素形成的化合物在实验室和工业生产上有着广泛的应用。回答下列问题:
(1)SCN-与Fe3+可形成多种配离子,其中一种为[Fe(SCN)6]3-,该配离子中的SCN-会使Fe3+的剩余价电子压缩配对,则每个配离子中Fe3+的单电子个数为_________个。
(2)Se与S是同族元素,请写出基态Se原子电子排布式_____________。H2Se的酸性比H2S________(填“强”或“弱”)。H2O、H2S、H2Se沸点由高到低的顺序为__________________,原因是:___________。
(3)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为_______,其VSEPR构型为_____________。
(4)已知S4O62-的结构为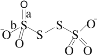 ,其中S原子的杂化方式是_______________。键长a______b(填“>”、“<”或“=”)。
,其中S原子的杂化方式是_______________。键长a______b(填“>”、“<”或“=”)。
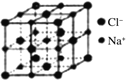
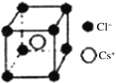
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:
| 半径比 | 0.225~0.414 | 0.414~0.732 | 0.732~1 |
| 典型化学式 | 立方ZnS | NaCl | CsCl |
| 晶胞 | 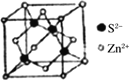
| 
| 
|
已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为M g/mol,则阳离子配位数为___________,晶体的密度为_________g/cm3(列出计算式,无需化简,设NA为阿伏加德罗常数的值)。
-
已知N、S、Cl元素可形成多种物质,在工业生产上有着广泛的应用。回答下列问题:
(1)Fe3+可与SCN-形成多种配离子,其中一种为[Fe(SCN)6]3-,该配离子中的SCN-会使铁的剩余价电子压缩配对,则每个配离子中铁的单电子个数为_______个。
(2)Se与S是同族元素,请写出基态Se原子电子排布式______。N与S是不同族元素,请解释NH3比H2S在水中溶解度大的原因:__________________。
(3)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为__________。借助等电子体原理可以分析出SCN-中σ键和π键的个数比为__________。
(4)已知S4O62-的结构为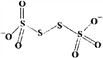 ,其中S原子的杂化方式是______。 N、P可分别形成多种三角锥型分子,已知NH3的键角大于PH3,原因是____________。
,其中S原子的杂化方式是______。 N、P可分别形成多种三角锥型分子,已知NH3的键角大于PH3,原因是____________。
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:

已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为Mg/mol,则阳离子配位数为_________,晶体的密度为_________g/cm3(列出计算式,无需化简,设NA为阿伏加德罗常数的值)。
-
锌、铁、铜及其化合物在生活、生产中有着广泛应用。回答下列问题:
(1)基态Fe3+的核外电子排布式为____________。在第四周期过渡元素中,基态原子未成对电子数最多的元素为____________(用元素符号表示)。
(2)一水合甘氨酸锌[(H2NCH2COO)2Zn·H2O]是一种饲料添加剂,该化合物中所涉及的非金属元素电负性由大到小的顺序是____________(用元素符号表示);甘氨酸分子中N原子的杂化轨道类型为____________;从结构角度解释甘氨酸易溶于水的原因:________________。
(3)铜元素的第一电离能、第二电离能分别为746 kJ·mol-1、1958 kJ·mol-1;锌元素的第一电离能、第二电离能分别为906 kJ·mol-1、1733 kJ·mol-1,铜的第二电离能大于锌的第二电离能,其主要原因是___________________________________________________。
(4)磷酸铁(FePO4)可用于制造磷酸铁锂电池材料,PO 的空间构型为______________。
的空间构型为______________。
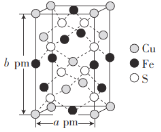
(5)某种化合物由Fe、Cu、S三种元素组成,其晶胞结构如图所示,则化学式为__________,该晶胞上、下底面均为正方形,侧面与底面垂直,若该晶体的密度ρ g·cm-3,设NA为阿伏加德罗常数的值,结合图中的数据计算底面棱长a=____________(只要求列出计算式,用含b的代数式表示)pm。
-
镁、铝、硅、银、铁的单质及其化合物在建筑业、飞机制造业、电子工业和石油化工等方面应用广泛。回答下列问题:
(1)Fe3+价层电子的轨道表达式(电子排布图)为__。
(2)硅能形成多种化合物(如SiH4、Si2H4等),SiH4的中心原子的杂化轨道类型为__,其分子的立体构型为__,键角为__;Si2H4分子中含有的σ键和π键的数目之比为__。
(3)Mg、Al的第一电离能:Mg__Al(填“>”或“<”)。
(4)Ca和Fe属于同一周期,且核外最外层电子构型相同,但金属Ca的熔点、沸点等都比金属Fe低,原因是__。
(5)Ag晶体的堆积方式为面心立方最密堆积(如图所示),晶胞中Ag原子的配位数为__;设Ag原子半径为rcm,阿伏加德罗常数的值用NA表示,则Ag晶体的密度为__g·cm-3(写出表达式)。

-
由H、C、N、O、S等元素形成多种化合物在生产生活中有着重要应用。
I.化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇,回答下列问题:
(1)对甲烷而言,有如下两个主要反应:
①CH4(g)+1/2O2(g)=CO(g)+2H2(g)△H1=-36kJ·mol-1
2CH4(g)+H2O(g)=CO(g)+3H2(g)△H2=+216kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,每生产lmolCO,转移电子的数目为______________________。
(2)甲醇催化脱氢可制得重要的化工产品一甲醛,制备过程中能量的转化关系如图所示。
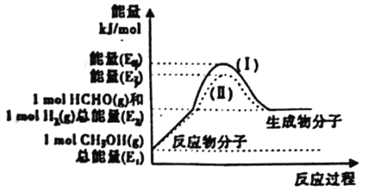
①写出上述反应的热化学方程式________________________________。
②反应热大小比较:过程I________过程Ⅱ(填“大 于”、“小于”或“等于”)。
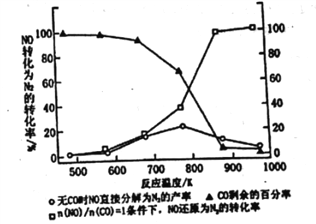
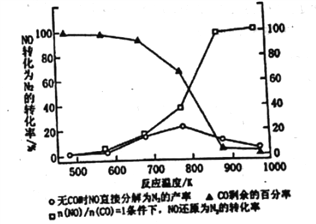
Ⅱ.(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领城的重要课题。某研究性小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775K,发现NO的分解率降低。其可能的原因为_____________________________________,在n(NO)/n(CO)=1的条件下,为更好的除去NOx物质,应控制的最佳温度在_______K左右。
(4)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
| 物质 温度℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式_________________________________________;
②若T1<T2,则该反应的ΔH_________0(填“>”、“<”或“=”);
③上述反应T1℃时达到化学平衡后再通入0.1mol NO气体,则达到新化学平衡时NO的转化率为______。
-
由H、C、N、O、S等元素形成多种化合物在生产生活中有着重要应用。
I.化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇,回答下列问题:
(1)对甲烷而言,有如下两个主要反应:
①CH4(g) +1/2O2(g) =CO(g) +2H2(g)△H1=-36kJ·mol-1
2CH4(g) +H2O(g) =CO(g) +3H2(g) △H2=+216kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,年生产lmolCO,转移电子的数目为______________________。
(2)甲醇催化脱氢可制得重要的化工产品一甲醛,制备过程中能量的转化关系如图所示。
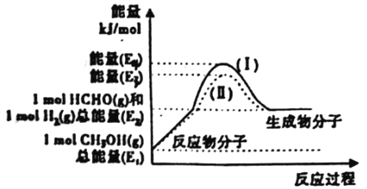
①写出上述反应的热化学方程式________________________________。
②反应热大小比较:过程I________过程II (填“大 于”、“小于”或“等于”)。
II.(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领城的重要课题。某研究性小组在实验室以Ag-ZSM-5为催化剂,删得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775K,发现NO的分解率降低。其可能的原因为_____________________________________,
在n(NO)/n(CO)=1的条件下,为更好的除去NOx物质,应控制的最佳温度在_______K左右。
(4)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃ 和T2℃时,测得各物质平衡时物质的量(n/mol) 如下表:
| 物质 温度℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式_________________________________________;
②若T1<T2,则该反应的ΔH_________0 (填“>”、“<”或“=”) ;
③上述反应T1℃时达到化学平衡后再通入0.1mol NO气体,则达到新化学平衡时NO的转化率为______。
-
自然界中存在大量的金属元素,在工农业生产中有着广泛的应用。回答下列问题:
(1)焰色反应的光谱属于发射光谱,铜和含铜离子化合物的焰色为_______色。
(2)基态Ni原子中,核外电子占据的最高能层符号是________,其核外电子排布式中未成对电子数为_________个。
(3)钌-多吡啶配合物具有丰富的光化学和光物理信息,结构简式如下图所示。钌(Ⅱ)的配位数是_______,N原子的杂化类型为______________。
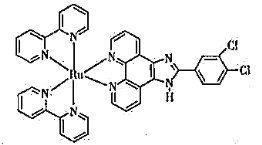
(4) 晶体中,
晶体中, 的重复排列方式如图所示,该排列方式中存在着如由1、3、6、7的
的重复排列方式如图所示,该排列方式中存在着如由1、3、6、7的 围成的正四面体空隙和3、6、7、8、9、12的
围成的正四面体空隙和3、6、7、8、9、12的 围成的正八面体空隙。
围成的正八面体空隙。 中有一半的
中有一半的 填充在正四面体空隙中,另一半
填充在正四面体空隙中,另一半 和全部
和全部 填充在正八面体空隙中,则
填充在正八面体空隙中,则 晶体中,正八面体空隙数与
晶体中,正八面体空隙数与 数之比为__________。正四面体空隙填充率与正八面体空隙填充率之比为________。
数之比为__________。正四面体空隙填充率与正八面体空隙填充率之比为________。 晶胞中有8个图示结构单元,该晶胞参数为a pm,则晶体密度为________
晶胞中有8个图示结构单元,该晶胞参数为a pm,则晶体密度为________ (写出含a和
(写出含a和 的计算表达式)。
的计算表达式)。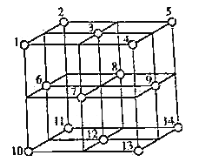
-
铁及其化合物在生产生活中有着广泛的应用。回答下列问题:
(1)基态Fe原子的外围电子排布图为____,基态Fe2+中,核外电子占据最高能层的符号是____,Fe2+和Fe3+是铁的两种常见离子,Fe3+的稳定性强于Fe2+,原因是____。
(2)Fe3+可以与SCN—形成一系列不同配位数的红色配合物,所以常用KSCN溶液检验Fe3+的存在,KSCN中四种元素的电负性由小到大的顺序为_______,SCN—的几何构型为______,中心原子的杂化类型为_______。
(3)实验中常用K3[Fe(CN)6]检验Fe2+, K3[Fe(CN)6]晶体中的化学键有_________(填写选项字母)
a.离子键. b.共价键 c,氢键 d .配位键 e.金属键
1mol K3[Fe(CN)6]中含有σ键与π键的数目比为_____________。
(4)FexO为氯化钠型结构,在实际晶体中,由于存在缺陷,x<1。 测得Fe0.92O晶体的晶胞参数a=428.0pm,则该晶体的密度ρ=__________g/cm3 (列出计算式),晶体中最近的两个铁离子间的距离为_______pm。
-
铁、碳等元素的单质及其化合物在化工医药、材料等领域有着广泛的应用。回答下列问题:
(1)Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为___,所含非金属元素的电负性由大到小的顺序为___。碳原子为____杂化,NO3-的空间构型为____。
(2)目前发现的铝原子簇Al13的性质与卤素相似,则原子簇Al13属于____晶体。Na[Al(OH)4]存在的化学键有 ___(填字母)。
A 离子键 B 极性键 C 非极性键 D 配位键 E 氢键 F 金属键
(3)已知:
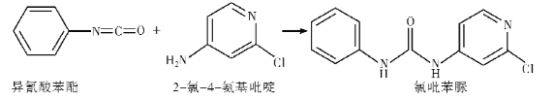
反应后,当σ键增加了1 mol时,π键___(填“增加”或“减少”)了____个。
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,如SO2分子中存在“离域π键”,可表示成π34,则 (咪唑)中的“离域兀键”可表示为_______
(咪唑)中的“离域兀键”可表示为_______
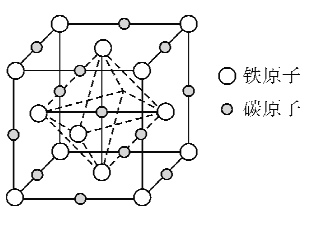
(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子之间的距离为_____ pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
-
铁、碳等元素的单质及其化合物在化工医药、材料等领域有着广泛的应用。回答下列问题:
(1)Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为___,所含非金属元素的电负性由大到小的顺序为___。碳原子为____杂化,NO3-的空间构型为____。
(2)目前发现的铝原子簇Al13的性质与卤素相似,则原子簇Al13属于____晶体。Na[Al(OH)4]存在的化学键有 ___(填字母)。
A 离子键 B 极性键 C 非极性键 D 配位键 E 氢键 F 金属键
(3)已知:
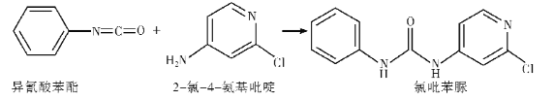
反应后,当σ键增加了1 mol时,π键___(填“增加”或“减少”)了____个。
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,如SO2分子中存在“离域π键”,可表示成π34,则 (咪唑)中的“离域兀键”可表示为_______
(咪唑)中的“离域兀键”可表示为_______
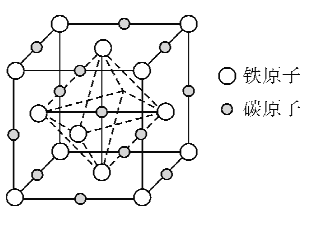
(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子之间的距离为_____ pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
 ,其中S原子的杂化方式是_______________。键长a______b(填“>”、“<”或“=”)。
,其中S原子的杂化方式是_______________。键长a______b(填“>”、“<”或“=”)。


 ,其中S原子的杂化方式是______。 N、P可分别形成多种三角锥型分子,已知NH3的键角大于PH3,原因是____________。
,其中S原子的杂化方式是______。 N、P可分别形成多种三角锥型分子,已知NH3的键角大于PH3,原因是____________。











