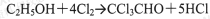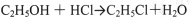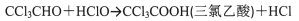-
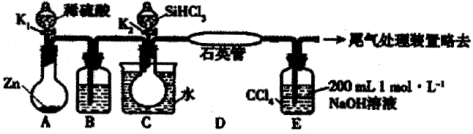
某实验小组模拟工业上用SiHCl3与H2在1357 K的条件下制备高纯硅,实验装置如下图所示 (加热及夹持装置略去):(SiHCl3相对分子质量为:135.5)

已知SiHCl3的性质如下:沸点为33.0℃;密度为1.34 g·mL-1;易溶于有机溶剂;能与H2O剧烈反应;在空气中易被氧化。请回答:
(1)装置C中的烧瓶用水浴加热的优点为_____________________。
(2)装置D中发生反应的化学方程式为_____________________。
(3)装置E的作用为___________________。
(4)相关实验步骤如下,其合理顺序为_______________ (填序号)。
①加热装置C,打开K2,滴加6.5 mL SiHCl3;
②打开K1,装置A中反应一段时间;
③关闭K1; ④关闭K2; ⑤加热装置D至1357 K。
(5)计算SiHCl3的利用率:对装置E中液体进行分液操作,取上层液体20.00 mL转移至锥形瓶中,滴加几滴酚酞溶液。用0.1 mol·L-1盐酸滴定,达到滴定终点时,消耗盐酸20.00 mL。达到滴定终点的现象是____________。SiHCl3的利用率为__________%(保留两位小数)。
(6)设计实验,检验SiHCl3与水反应后,所得溶液中存在盐酸___________________
-
某实验小组模拟工业上用SiHC13与H2在1357 K的条件下制备高纯硅,实验装置如下图所示(加热及夹持装置略去):
已知SiHC13的性质如下:沸点为33.0℃,密度为1.34 g/mL,易溶于有机溶剂,能与H2O剧烈反应;在空气中易被氧化。请回答:
(1)组装好仪器后,应先进行的操作是_________。
(2)①装置B中的试剂是_________,②装置D中发生反应的化学方程式为_________。
(3)装置E中CCl4的作用为_________、_________。
(4)相关实验步骤如下.其合理顺序为_________(填序号)。
①加热装置D至1357 K;②打开K1,装置A中反应一段时间:③关闭K1;④关闭K2;⑤加热装置C,打开K2,滴加6.5mLSiHC13。
(5)计算SiHC13的利用率:对装置E中液体进行分液操作后,取上层液体20.00 mL转移至锥形瓶中,滴加几滴酚酞溶液。用0.10 mol/L盐酸滴定,达到滴定终点的现象是_________,进行三次平行滴定,平均每次消耗盐酸20.00 mL,则SiHC13的利用率为_________ %(保留两位小数)。
-
氯化苄(C6H5CH2Cl)为无色液体,是一种重要的有机化工原料。现在实验室模拟工业上用甲苯与干燥氯气在光照条件下加热反应合成氯化苄、分离出氯化苄并检验样品的纯度,其装置(夹持装置略去)如图所示:

回答下列问题:
(1)仪器E的名称是_____________;其作用是_______________________________________。
(2)装置B中的溶液为___________________。
(3)用恒压滴液漏斗代替分液漏斗的优点是__________________________________________。
(4)装置A中反应的离子方程式为__________________________________________________。
(5)反应结束后,关闭K1和K2,打开K3,加热三颈烧瓶,分馏出氯化苄,应选择温度范围为______℃。
| 物质 | 溶解性 | 熔点(℃) | 沸点(℃) |
| 甲苯 | 极微溶于水,能与乙醇、乙醚等混溶 | -94.9 | 110 |
| 氯化苄 | 微溶于水,易溶于苯、甲苯等有机溶剂 | -39 | 178.8 |
| 二氯化苄 | 不溶于水,溶于乙醇、乙醚 | -16 | 205 |
| 三氯化苄 | 不溶于水,溶于乙醇、乙醚和苯 | -7 | 220 |
(6)检测氯化苄样品的纯度:
①称取13.00g样品于烧杯中,加入50.00mL 4 mol•L-1 NaOH水溶液,水浴加热1小时,冷却后加入35.00mL 40% HNO3,再将全部溶液转移到容量瓶中配成100mL溶液。取20.00mL溶液于试管中,加入足量的AgNO3溶液,充分振荡,过滤、洗涤、干燥,称量固体质量为2.87g,则该样品的纯度为_____%(结果保留小数点后1位)。
②实际测量结果可能偏高,原因是__________________________________________________。
-
三氯乙醛是基本有机合成原料之一,是生产农药、医药的重要中间体。某化学兴趣小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。
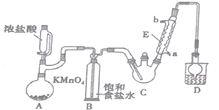
查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl,可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O、CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl;
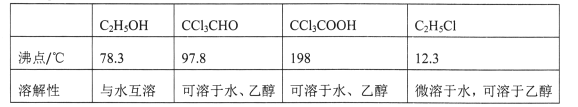
②相关物质的相对分子质量及部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(1)仪器E的名称是____________,冷凝水的流向是________进_______出(填“a”或“b”)。
(2)该装置C可采用_______________,加热的方法以控制反应温度在70 ℃左右。
(3)装置D干燥管的作用为_______________,装置D烧杯中的试剂是_________。
(4)该设计流程中存在一处缺陷,该缺陷是__________,引起的后果是________。
(5)反应结束后,从C中的混合物中分离出Cl3CCOOH的方法是________(填名称)。
(6)仪器A中发生反应的离子方程式为_________。
(7)已知:常温下Ka(CCl3COOH)=1.0×10-1mol·L-1,Ka(CH3COOH)=1.7×10-5mol·L-1,请设计实验证明三氯乙酸、乙酸的酸性强弱:______。
-
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。查阅资料,有关信息如下:
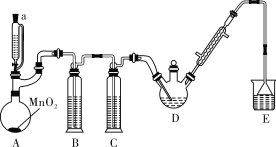
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl,可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O;CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl |
| 熔点/℃ | —114.1 | —57.5 | 58 | —138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
(1)仪器 A 中发生反应的化学方程式是__________;装置B中的试剂是______。
(2)若撤去装置C,可能导致装置D中副产物_________ (填化学式)的量增加;装置D可采用__________加热的方法以控制反应温度在70℃左右。
(3)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH。你认为此方案是否可行,为什么?____________。
(4)装置E中盛有NaOH溶液,写出该装置中所有可能发生的无机反应的离子方程式:_______________。
(5)测定产品纯度:称取产品0.30g配成待测溶液,加入0.1000mol·L一1 碘标准溶液20.00mL,再加入适量 Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol·L一1Na2S2O3溶液滴定至终点。进行平行实验后,测得消耗Na2S2O3溶液20.00mL。则产品的纯度为________。(CCl3CHO的相对分子质量为147.5) 滴定的反应原理:CCl3CHO+OH一 = CHCl3+HCOO一、 HCOO一 +I2 =H+ + 2I- + CO2↑、I2 + 2S2O32一 = 2I- +S4O62一
-
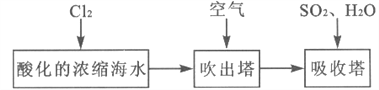
工业生产中,海水提溴常用空气吹出法。某化学实验小组设计了如图实验装置(夹持装置略去)模拟该法从浓缩的海水中提取溴。已知: 的沸点为58.78℃,密度为3.119
的沸点为58.78℃,密度为3.119 ,微溶于水,有毒。
,微溶于水,有毒。
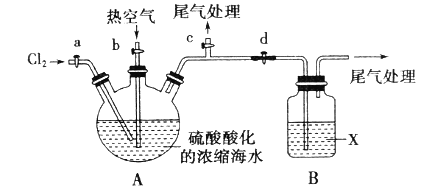
实验步骤如下:
①关闭活塞b、d,打开活塞a、c,向A中缓慢通入 至反应结束;
至反应结束;
②关闭活塞a、c,打开活塞b、d,向A中鼓入足量热空气;
③关闭活塞b,打开活塞a,再通过A向B中通入足量 ;
;
④取B中所得溶液进行蒸馏,收集液溴。
(1)步骤①的A中发生的主要反应的离子方程式为__________。
(2)X试剂可以是_________(填序号),步骤②的B中X试剂与 发生反应的离子方程式为__________。
发生反应的离子方程式为__________。
a.
b.饱和食盐水
c.饱和 溶液
溶液
(3)该实验中尾气处理所用的试剂可为__________。
(4)蒸馏时,除酒精灯、石棉网、带铁圈的铁架台外,还应该选择仪器__________(填序号)。蒸馏操作中应控制温度为________。
-
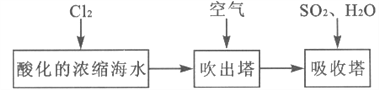
工业以浓缩海水为原料提取溴的部分过程如下:
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):

(1)实验开始时,A装置中不通热空气,先通入a气体的目的是(用离子方程式表示)_________。
(2)A装置中通入a气体一段时间后,停止通入,改通热空气。通入热空气的目的是_________。
(3)反应过程中,B装置中Br2与SO2反应的化学方程式____________________。
(4)C装置的作用是___________________。
(5)该小组同学向反应后B装置的溶液中通入氯气,充分反应得到混合液。
①一位同学根据溴的沸点是59℃,提出采用____________________方法从该混合液中分离出溴单质。
②另一位同学向该混合液中加入四氯化碳,充分振荡、静置后放出下层液体,这种方法是________。
(6)某同学提出证明反应后B装置的溶液中含有溴离子的实验方案是:取出少量溶液,先加入过量新制氯水,再加入KI淀粉溶液,观察溶液是否变蓝色。该方案是否合理并简述理由: _______。
-
工业以浓缩海水为原料提取溴的部分过程如下:
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):
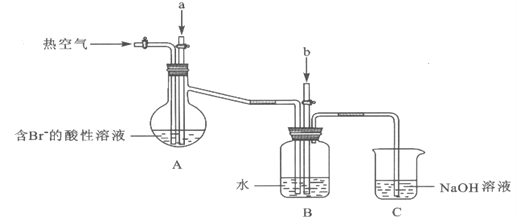
(1)实验开始时,A装置中不通热空气,先通入a气体的目的是(用离子方程式表示)_________。
(2)A装置中通入a气体一段时间后,停止通入,改通热空气。通入热空气的目的是_________。
(3)反应过程中,B装置中Br2与SO2反应的化学方程式____________________。
(4)C装置的作用是___________________。
(5)该小组同学向反应后B装置的溶液中通入氯气,充分反应得到混合液。
①一位同学根据溴的沸点是59℃,提出采用____________________方法从该混合液中分离出溴单质。
②另一位同学向该混合液中加入四氯化碳,充分振荡、静置后放出下层液体,这种方法是________。
(6)某同学提出证明反应后B装置的溶液中含有溴离子的实验方案是:取出少量溶液,先加入过量新制氯水,再加入KI淀粉溶液,观察溶液是否变蓝色。该方案是否合理并简述理由: _______。
-
某化学兴趣小组设计如图所示装置(夹持、加热仪器略),模拟工业生产三氯乙醛(CCl3CHO)的方法,由乙醇与氯气作用,制得三氯乙醛。
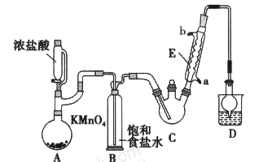
查阅资料,有关信息如下:
①制备反应原理: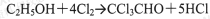
可能发生的副反应: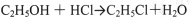
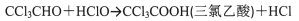
②相关物质的相对分子质量及部分物理性质:
(1)仪器C和E的名称分别是____,____。
(2)仪器A中发生反应的离子方程式为____ 。
(3)该装置C最好采用____加热的方法,以控制反应温度在70℃左右。
(4)该设计流程中存在一处缺陷,该缺陷可能引起的后果是________。
(5)反应结束后,从C中的混合物中分离出CCl3COOH的方法是_____(填名称)。
-
亚硝酸钠(NaNO2)是一种工业盐,实验室可用如下装置(略去部分夹持仪器)制备。
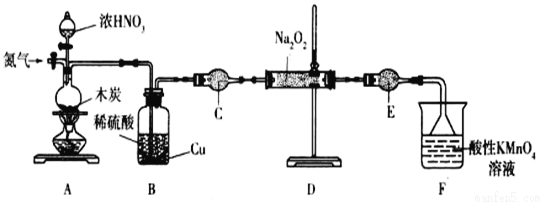
已知:①2NO+Na2O2=2NaNO2; ②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;③酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色。
(1)加热装置A前,先通一段时间N2,目的是_______________。
(2)装置A中发生反应的化学方程式为__________________________________。实验结束后,将B瓶中的溶液经蒸发浓缩、__________(填操作名称)、过滤可获得CuSO4·5H2O。
(3)仪器C的名称为______________,其中盛放的药品为 ____________(填名称)。
(4)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,________________,则产物是NaNO2(注明试剂、现象)。
(5)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:

①第一组实验数据出现异常,造成这种异常的原因可能是_________(填代号)。
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时仰视读数
②根据表中数据,计算所得固体中亚硝酸钠的质量分数__________。