-
已知25℃时,醋酸、氢硫酸、氢氰酸的电离平衡常数如下表:(单位省略)
醋酸
氢硫酸
氢氰酸
Ka=1.8×10-5
Ka1=9.1×10-8
Ka2=1.1×10-12
Ka=4.9×10-10
(1)体积相同、c(H+)相同的三种酸溶液a.CH3COOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)___________。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2S溶液、③CH3COONa溶液,pH由大到小的顺序为_____________(填序号)。
(3)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,阴离子总浓度由大到小的顺序为 _____________(填序号)。
(4)将浓度为0.02mol/L的HCN 与0.01mol/L NaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是_______。
a.c(H+)<c(OH-) b.c(H+)+c(HCN)=c(OH-)+c(CN-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,向NaCN溶液中通入少量H2S,反应的离子方程式为___________________。
高二化学综合题困难题查看答案及解析
-
已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表:(单位省略)
醋酸
碳酸
氢氰酸
Ka=1.7×10-5
Ka1=4.2×10-7 Ka2=5.6×10-11
Ka=6.2×10-10
(1)写出碳酸的第一步电离方程式___________。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2CO3溶液、③CH3COONa 溶液,pH由大到小的顺序为_______(填序号)。
(3)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为___________。
(4)将浓度为0.02mol/L的HCN 与0.01mol/LNaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是_______。
a.c(H+)-) b.c(H+)+c(HCN)=c(OH-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,阴离子总浓度由大到小的顺序为_______(填序号)。
(6)NaCN是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康,可用以下方法测定处理后的废水中NaCN的含量。已知:
①废水中NaCN 的最高排放标准为0.50mg/L;
②Ag+ +2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI沉淀呈黄色,且CN- 优先与Ag+反应。
实验如下:20.00mL处理后的含NaCN 的废水于锥形瓶中,并滴加几滴KI 溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为15.00mL。
①滴定时1.00×10-4mol/L的标准AgNO3溶液应用______(填仪器名称)盛装;滴定终点时的现象是_________。
②处理后的含NaCN 的废水是否达到排放标准_____(填“是”或“否”)。
高二化学综合题困难题查看答案及解析
-
I.已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表:(单位省略)
醋酸
碳酸
氢氰酸
Ka=1.7×10
Ka1=4.2×10
Ka2=5.6×10
Ka=6.2×10
(1)写出碳酸的第一步电离方程式__________________________________。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2CO3溶液、③CH3COONa 溶液,pH由大到小的顺序为_____________________ (填序号)。
(3)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为_______________。
(4)将浓度为0.02mol/L的HCN 与0.01mol/LNaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN
),下列关系正确的是_______。
a.c(H+)>c(OH
) b.c(H+)+c(HCN)=c(OH
) c.c(HCN)+c(CN
)=0.01mol/L
II.请用有关电解质溶液的知识回答下列问题:
(1)某温度下纯水的c(H+)=4.0×10
mol/L,若温度不变,滴入稀盐酸,使c(H+)=2.0×10
mol/L,则此溶液中由水电离产生的c(H+)=_________。
(2)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s) ⇌Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10
。某硫酸铜溶液里c(Cu2+)=0.02 mol·L
,如要生成Cu(OH)2沉淀,应调整溶液使之pH>________
(3)向含有相同浓度Fe2+、Hg2+的溶液中滴加Na2S溶液,先生成______沉淀(填化学式)。在工业废水处理过程中,依据沉淀转化原理,可用FeS作为沉淀剂除去废水中的Hg2+,写出相应的离子方程式______________________。(Ksp(FeS)=6.3×10
,Ksp(HgS)=6.4×10
)
高二化学填空题中等难度题查看答案及解析
-
弱电解质有许多如:醋酸、碳酸、氢氰酸、一水合氨等,已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表
氢氰酸
碳酸
醋酸
Ka=6.2×10-10
Ka1=4.2×10-7 Ka2=5.6×10-11
Ka=1.7×10-5
(1)25℃时,pH相等的三种溶液①CH3COONa溶液、②Na2CO3溶液、③NaCN溶液,浓度由大到小的顺序为____(填序号)。
(2)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为_________。
(3)将浓度为0.02mol/L的HCN 与0.01mol/LNaOH 溶液等体积混合,则混合溶液中c(H+) _____c(OH-)(用 < > = 填空)
(4)常温下,向浓度为0.1 mol·L-1、体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
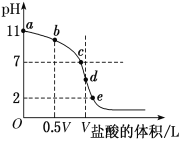
①该温度时NH3·H2O的电离常数K=______。
②比较b、c、d三点时的溶液中,由水电离出的c(H+)由大到小顺序为________。
③滴定时,由b点到c点的过程中,下列各选项中数值保持不变的是________(填字母,下同)。
A.c(H+)·c(OH-) B.
C.
D.
④根据以上滴定曲线判断下列说法正确的是________(溶液中N元素只存在NH
和NH3·H2O两种形式)。
A.点b所示溶液中:c(NH
)+c(H+)=c(OH-)+c(NH3·H2O)
B.点c所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH
)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH
)>c(OH-)
D.滴定过程中可能有:c(NH3·H2O)>c(NH
)>c(OH-)>c(Cl-)>c(H+)
高二化学填空题中等难度题查看答案及解析
-
已知部分弱酸的电离平衡常数如下表:
弱酸
醋酸
次氯酸
碳酸
亚硫酸
电离平衡常数
Ka=1.75×10﹣5
Ka=2.98×10﹣8
Ka1=4.3×10﹣7
Ka2=5.61×10﹣11
Ka1=1.54×10﹣2
Ka2=1.02×10﹣7
下列离子方程式正确的是( )
A.少量的CO2通入NaClO溶液中:CO2+H2O+2ClO﹣═CO32﹣+2HClO
B.少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32﹣═SO32﹣+2HCO3﹣
C.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO﹣═CaSO3↓+2HClO
D.相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3﹣═CO2↑+2H2O
高二化学单选题中等难度题查看答案及解析
-
已知部分弱酸的电离平衡常数如下表:
弱酸
醋酸
次氯酸
碳酸
亚硫酸
电离平衡常数(25℃)
Ka=1.75×10-5
Ka=2.98×10-8
Ka1=4.30×10-7
Ka2=5.61×10-11Ka1=1.54×10-2
Ka2=1.02×10-7下列离子方程式正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=CO
+2HClO
B.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.少量的SO2通入Na2CO3溶液中:SO2+H2O+2 CO
=SO
+2HCO3-
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O
高二化学单选题困难题查看答案及解析
-
已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
醋酸
碳酸
亚硫酸
Ka= 1.75×10-5
Ka1= 4.30×10-7 Ka2 = 5.61×10-11
Ka1= 1.54×10-2 Ka2 = 1.02×10-7
(1)写出碳酸的第二步电离平衡常数表达式Ka2= 。
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱 > > 。
(3)下图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液pH随水量的变化:
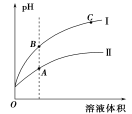
①图像中,曲线I表示的酸是 (填化学式)。
②A、B、C三点中,水的电离程度最大的是 (填字母)。
高二化学填空题困难题查看答案及解析
-
(8分)已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
醋酸
碳酸
亚硫酸
Ka= 1.75×10-5
Ka1= 4.30×10-7 Ka2 = 5.61×10-11
Ka1= 1.54×10-2 Ka2 = 1.02×10-7
(1)写出碳酸的第一步电离平衡常数表达式:Ka1 = 。
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱: > > 。
(3)下图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液PH随水量的变化
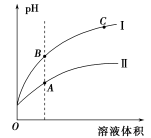
①图像中,曲线I表示的酸是 (填化学式)。
②A、B、C三点中,水的电离程度最大的是 (填字母)。
高二化学填空题困难题查看答案及解析
-
已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是
酸
醋酸
次氯酸
碳酸
亚硫酸
电离平衡常数
K a=1.75×10-5
K a=2.98×10-8
Ka1=4.30×10-7 Ka2=5.61×10-11
Ka1=1.54×10-2 Ka2=1.02×10-7
A. 25℃,等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3
B. 将0.1 mol·L-1的醋酸加水不断稀释,所有离子浓度均减小
C. 少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
D. 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO
高二化学选择题困难题查看答案及解析
-
已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
醋酸
碳酸
亚硫酸
Ka=1.75×10﹣5
Ka1=4.30×10﹣7 Ka2=5.61×10﹣11
Ka1=1.54×10﹣2 Ka2=1.02×10﹣7
(1)写出碳酸的第一步电离平衡常数表达式:Ka1=__.
(2)在相同条件下,试比较H2CO3、HCO3﹣和HSO3﹣的酸性强弱:__>__>__.
(3)如图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液pH随水量的变化图象中:
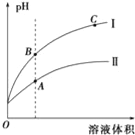
①曲线I表示的酸是__(填化学式).
②A、B、C三点中,水的电离程度最大的是__(填字母).
(4)下列事实不能说明醋酸是弱酸的是_______
①当温度低于16.6℃时醋酸可凝结成冰一样晶体
②0.1mol/L的醋酸钠溶液的pH约为9
③等体积等物质的量浓度的硫酸比醋酸消耗氢氧化钠多
④0.1mol/L的醋酸的pH约为4.8
⑤pH都等于4且等体积的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸消耗碱液多
⑥同物质的量浓度的醋酸和盐酸加水稀释至pH相同时,醋酸加入的水多
高二化学填空题中等难度题查看答案及解析