-
25 ℃时,CH3COOH的电离平衡常数Ka=1.75×10-5,NH3·H2O的电离平衡常数Kb=1.75×10-5,现在25 ℃时向10 mL浓度均为0.1 mol·L-1的HCl和CH3COOH的混合溶液中逐滴加入0.1 mol·L-1的氨水,溶液的pH变化曲线如图所示。下列有关说法不正确的是( )

A.A点到B点,溶液的导电性逐渐减小
B.整个过程中,C点处水的电离程度最大
C.pH =7时对应的点应在C点和D点之间,此时溶液中存在:c(NH4+)=c(CH3COO-)+c(CH3COOH)
D.D点处:c(NH4+)>c(Cl-)>c(CH3COO-)>c(OH-)>c(H+)
-
25℃下,电离平衡常数Ka(CH3COOH) = Kb(NH3•H2O) = 1.75×10-5,下列说法正确的是( )
A.用0.1mol/L的盐酸滴定0.1mol/L的氨水时,可用酚酞作指示剂
B.0.2mol/L的醋酸与0.1mol/L的氢氧化钠溶液等体积混合,所得溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH) +c(H+)
C.pH=3的盐酸与pH=11的氨水等体积混合,所得溶液中c(OH -) > c(H+)
D.pH=3的醋酸与pH=11的氨水等体积混合,所得溶液中由水电离出的c(H+)=1×10-7mol/L
-
已知常温时CH3COOH的电离平衡常数Ka=1.75×10−5,NH3·H2O的电离平衡常数Kb=1.75×10−5。常温时,向10 mL浓度均为0.01mol·L−1的NaOH和氨水混合溶液中,逐滴加入0.01mol·L−1的 CH3COOH 溶液,混合溶液的pH与加入CH3COOH的体积V之间的变化曲线如图所示,下列有关说法正确的是
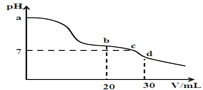
A. a 点溶液的pH<12
B. b 点时水的电离程度最大
C. c 点处的微粒间存在:c(CH3COO−)=c(NH4+)+c(NH3·H2O)
D. d 点处的微粒间存在:c(CH3COO−)>c(H+)>c(Na+)>c(NH4+)>c(OH−)
-
已知常温时CH3COOH的电离平衡常数Ka=1.75×10−5,NH3·H2O的电离平衡常数Kb=1.75×10−5。常温时,向10 mL浓度均为0.01mol·L−1的NaOH和氨水混合溶液中,逐滴加入0.01mol·L−1的 CH3COOH 溶液,混合溶液的pH与加入CH3COOH的体积V之间的变化曲线如图所示,下列有关说法正确的是

A. a 点溶液的pH<12
B. b 点时水的电离程度最大
C. c 点处的微粒间存在:c(CH3COO−)=c(NH4+)+c(NH3·H2O)
D. d 点处的微粒间存在:c(CH3COO−)>c(H+)>c(Na+)>c(NH4+)>c(OH−)
-
已知常温下,3种物质的电离平衡常数如下表:
| 物质 | HCOOH | CH3COOH | NH3·H2O |
| 电离平衡常数K | 1.77×10−4 | 1.75×10−5 | 1.76×10−5 |
下列说法不正确的是
A.常温下,足量HCOOH溶液与Na2CO3溶液反应可生成无色气体
B.等物质的量浓度等体积的CH3COOH溶液和氨水混合,溶液pH约为7
C.HCOOH溶液与氨水混合,当溶液pH=7时,c(HCOO-)=c(NH4+)
D.pH均为3的HCOOH和CH3COOH溶液, c(HCOOH)>c(CH3COOH)
-
已知常温下,3种物质的电离平衡常数如下表:
| 物质 | HCOOH | CH3COOH | NH3·H2O |
| 电离平衡常数K | 1.77×10−4 | 1.75×10−5 | 1.76×10−5 |
下列说法不正确的是
A.等物质的量浓度时,溶液pH:HCOONa<CH3COONa
B.pH均为3时,溶液浓度:c(HCOOH)>c(CH3COOH)
C.HCOOH溶液与氨水混合,当溶液pH=7时,c(HCOO-)=c(NH4+)
D.等物质的量浓度等体积的CH3COOH溶液和氨水混合,溶液pH约为7
-
常温下,几种物质的电离平衡常数如表:下列说法正确的是( )
| HCOOH | CH3COOH | NH3·H2O |
| Ka | 1.77×10-4 | 1.75×10-5 | 1.76×10-5 |
A.浓度相同的HCOOH溶液与NH3·H2O溶液等体积混合,所得溶液显碱性
B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液,HCOOH消耗NaOH溶液的体积大
C.0.2mol·L-1HCOOH与0.1mol·L-1NaOH等体积混合后的溶液中:c(HCOO-)+c(OH-)=c(HCOOH)+c(H+)
D.0.2mol·L-1CH3COONa与0.1mol·L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-)>cCl-)>c(CH3COOH)>c(H+)
-
常温下,弱电解质的电离平衡常数Ka(CH3COOH)=Kb(NH3•H2O)=1.75×10-5,下列说法正确的是
A.用0.1mol/L的盐酸滴定0.1mol/L的氨水时,可用酚酞作指示剂
B.0.2mol/L的醋酸与0.1mol/L的氢氧化钠溶液等体积混合,所得溶液中c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
C.pH=3的醋酸与pH=11的氨水等体积混合,所得溶液中由水电离出的c(H+)=1×10-7mol/L
D.pH=3的盐酸与pH=11的氨水等体积混合,所得溶液中c(NH3•H2O)>c(NH4+)>c(Cl-)
-
25℃时,NH3·H2O的电离平衡常数Kb=1.75×10-5。该温度下,用0.01mol·L-1盐酸滴定10mLamol·L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示。下列说法正确的是
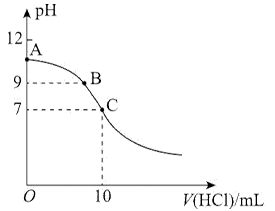
A. A点溶液中加少量水, 减小
减小
B. 原氨水的物质的量浓度约为1.006×10-2mol·L-1
C. A、B、C三点溶液中水电离出来的c(OH-):A>B>C
D. C点时,盐酸和氨水恰好完全反应
-
在25℃时,CH3COOH的电离平衡常数 ,NH3·H2O的电离平衡常数
,NH3·H2O的电离平衡常数 ,现向25℃的10mL浓度均为0.1moL·L-1的HCl和CH3COOH的混合溶液中逐滴加入0.1moL·L-1的氨水,溶液的pH变化曲线如图所示。下列有关说法不正确的是
,现向25℃的10mL浓度均为0.1moL·L-1的HCl和CH3COOH的混合溶液中逐滴加入0.1moL·L-1的氨水,溶液的pH变化曲线如图所示。下列有关说法不正确的是
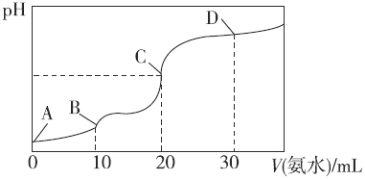
A. A点到B点,溶液的导电性逐渐减小
B. 整个过程中,C点水的电离程度最大
C. 溶液pH=7时对应的点应在C点和D点之间某处,此时溶液中存在:c(NH4+)=c(CH3COO-)+c(CH3COOH)
D. D点处:c(NH4+)>c(Cl-)>c(OH-)>c(CH3COO-)>c(H+)




