-
合成氨工业对化学工业和国防工业具有重要意义,对农业生产起着重要作用。
(1)已知:N2(g)+O2(g)=2NO(g) △H1
H2(g)+1/2O2(g)=H2O(1) △H2
4NH3(g)+5O2(g)=4NO(g)+6H2O(1) △H3
N2(g)+3H2(g)⇌2NH3(g) △H4<0
则△H4= (用含△H1、△H2、△H3的代数式表示)。
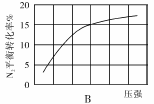
(2)在其他条件相同时,分别测定合成氨反应中N2的平衡转化率随压强变化的曲线如下图A、B所示,其中正确的是 (填“A”或“B”),其判断理由是 。

(3)在体积为2L的密闭容器中按物质的量1:3的比例充入N2、H2,进行下列四组合成氨实验:
| 组别 | 温度 | N2起始量/mol | N2的物质的量/mol |
| 5(s) | 10(s) | 15(s) | 20(s) | 25(s) | 30(s) | 35(s) |
| Ⅰ | T1 | 0.1 | 0.094 | 0.089 | 0.085 | 0.0825 | 0.081 | 0.080 | 0.080 |
| Ⅱ | T2 | 0.1 | 0.090 | 0.085 | 0.082 | 0.080 | 0.080 | 0.080 | 0.080 |
| Ⅲ | T3 | 0.2 | 0.179 | 0.165 | 0.153 | 0.146 | x | x | x |
| Ⅳ | T4 | 0.2 | 0.173 | 0.161 | 0.155 | 0.150 | 0.150 | 0.150 | 0.150 |
| | | | | | | | | |
①实验Ⅰ前10秒的平均速率v(NH3)= mol·L-1·s-1,T1温度下合成氨反应的平衡常数K= (列出计算式)。
②与实验Ⅰ相比,实验Ⅱ改变了一个条件,该条件可能是 。
③与实验I相比,实验Ⅲ中N2的平衡转化率 (填“增大”、“减小”或“不变”),平衡常数K (填“增大”、“减小”或“不变”)。
④实验Ⅲ与实验Ⅳ的反应条件温度不同,则T1 (填“大于”、“小于”或“等于”)T2,原因是 。
-
氨气是一种重要工业原料,在工农业生产中具有重要的应用。
(1)已知:N2(g)+O2(g)=2NO(g) △ H=+180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
则N2(g)+3H2(g)=2NH3(g)的△H=________________。
(2)工业合成氨气的反应为N2(g)+3H2(g) 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是____________。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
( 3 )①实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,画出反应及收集的简易装置;
实验室还可在 (填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
② 常温下氨气极易溶于水,溶液可以导电。氨水中水电离出的c(OH-) 10-7 mol·L-1(填写“>”、“<”或“=”);
③ 将相同体积、PH之和为14的氨水和盐酸混合后,溶液中离子浓度由大到小的顺序为 。
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行图所示实验:(其中a、b均为碳棒)。如右图所示:

右边Cu电极反应式是 ,a电极的电极反应式
-
氨是生产硝酸、尿素等物质的重要原料,工业合成氨是最重要的化工生产之一。
(1)氨催化氧化法是工业制硝酸的主要方法。
已知:2NO(g)+3H2(g) 2NH3(g)+O2(g) △H1=-272.9 kJ·mol-1,
2NH3(g)+O2(g) △H1=-272.9 kJ·mol-1,
2H2(g)+O2(g)═2H2O(g) △H2= -483.6kJ·mol-1,
则4NH3(g)+5O2(g)=4NO(g)+ 6H2O(g)△H3=________ 。
(2)恒容密闭容器中进行合成氨反应N2(g)+3H2(g) 2NH3(g)△H4=-92.4kJ·mol-1,其化学平衡常数(K)与温度的关系如下表:
2NH3(g)△H4=-92.4kJ·mol-1,其化学平衡常数(K)与温度的关系如下表:
| 温度/K | 298 | 398 | 498 | … |
| 平衡常数(K) | 4.1×105 | K1 | K2 | … |
K1 K2(填“>”或“<”),其判断理由是 。
(3)向氨合成塔中充入10molN2和40mol H2进行氨的合成,一定温度(T)下平衡混合物中氨气的体积分数与压强(p)的关系如图1所示。下列说法正确的是 (填字母)。
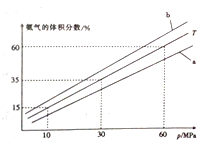
A.由图可知增大体系压强(p),有利于增大氨气在混合气体中的体积分数
B.若图中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高氮气的转化率
D.当3v正(H2)=2v逆(NH3)时,反应达到平衡状态当温度为T、氨气的体积分数为25%时,N2的转化率为 。
(4)工业上用NH3生产硝酸时,将NH3和O2按体积比1:2混合通入某特定条件的密闭容器中进行反应,所有物质不与外界交换,最后所得溶液中溶质的质量分数为 。
(5)氨碳比[n(NH3)/n(CaO2)]对合成尿素的反应:2NH3(g)+CO2(g) CO(NH2)2(g)+H2O(g)有影响。T℃时,在一定体积为2L的恒容密闭容器中,将物质的量之和为3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图所示,
CO(NH2)2(g)+H2O(g)有影响。T℃时,在一定体积为2L的恒容密闭容器中,将物质的量之和为3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图所示,
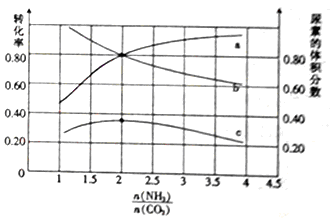
a、b分别表示CO2或NH3的转化率,c表示平衡体系中尿素的体积分数。[n(NH3)/n(CO2)] __ 时,尿素产量最大;该条件下反应的平衡常数K= ___ 。
-
氨是生产硝酸、尿素等物质的重要原料,工业合成氨是最重要的化工生产之一。
(1)氨催化氧化法是工业制硝酸的主要方法。
已知:2NO(g)+3H2(g) 2NH3(g)+O2(g) △H1=-272.9 kJ·mol-1, 2H2(g)+O2(g)═2H2O(g) △H2= -483.6kJ·mol-1,则4NH3(g)+5O2(g)=4NO(g)+ 6H2O(g)△H3= 。
2NH3(g)+O2(g) △H1=-272.9 kJ·mol-1, 2H2(g)+O2(g)═2H2O(g) △H2= -483.6kJ·mol-1,则4NH3(g)+5O2(g)=4NO(g)+ 6H2O(g)△H3= 。
(2)恒容密闭容器中进行合成氨反应N2(g) +3H2(g)  2NH3(g) △H4 = - 92. 4 kJ·mol-1,
2NH3(g) △H4 = - 92. 4 kJ·mol-1,
ΔS=-198.2J・mol-1・K-1。其化学平衡常数(K)与温度的关系如下表:
| 温度/K | 398 | 498 | … |
| 平衡常数(K) | K1 | K2 | … |
K1 K2(填“>”或“<”),请分析,298K时,合成氨反应能否自发进行 。
(3) 向氨合成塔中充入10molN2和40mol H2进行氨的合成,一定温度(T)下平衡混合物中氨气的体积分数与压强(p)的关系如图1所示。下列说法正确的是 (填字母)。
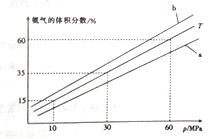
A.由图可知增大体系压强(p),有利于增大氨气在混合气体中的体积分数
B.若图中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高氮气的转化率
D.当3v正(H2)=2v逆(NH3)时,反应达到平衡状态
当温度为T、氨气的体积分数为25%时,N2的转化率为 。
(4)工业上用NH3生产硝酸时,将NH3和O2按体积比1:2混合通入某特定条件的密闭容器中进行反应,所有物质不与外界交换,最后所得溶液中溶质的质量分数为 。
(5)氨碳比[n(NH3)/n(CO2)]对合成尿素的反应:2NH3(g)+CO2(g) CO(NH2)2(g)+H2O(g)有影响。T℃时,在一定体积为2L的恒容密闭容器中,将物质的量之和为3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2或NH3的转化率,c表示平衡体系中尿素的体积分数。[n(NH3)/n(CO2)] 时,尿素产量最大;该条件下反应的平衡常数K= 。
CO(NH2)2(g)+H2O(g)有影响。T℃时,在一定体积为2L的恒容密闭容器中,将物质的量之和为3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2或NH3的转化率,c表示平衡体系中尿素的体积分数。[n(NH3)/n(CO2)] 时,尿素产量最大;该条件下反应的平衡常数K= 。

-
合成氨在工业生产中具有重要意义。
(1)在合成氨工业中I2O5常用于定量测定CO的含量。己知2I2(s)+5O2(g)=2I2O5(s) △H=-76kJ·mol-1;2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1。则该测定反应的热化学方程式为____________________________________。
(2)不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数φ (CO2)随时间t变化曲线如图。
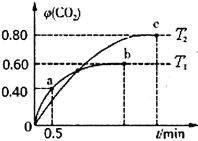
①温度T1时,0~0.5 min内的反应速率v(CO)=________________。
②b点CO的平衡转化率α为____________,c点的平衡常数K为________________。
③下列措施能提高该反应CO转化率的是________(填字母)
a.升高温度 b.增大压强 c.加入催化剂 d.移走CO2
(3)若氨水与SO2恰好生成正盐,则此时溶液呈_________(填“酸性”或“碱性”),向上述溶液中通入___________(填“NH3”或“SO2”)可使溶液呈中性,此时溶液中含硫微粒浓度的大小关系为________________。(已知常温下NH3·H2O的Kb=1.8×10-5mol·L-1,H2SO3的Ka1=1.5×10-2mol·L-1,Ka2=6.3×10-8mol·L-1)
-
氮是地球上含量丰富的一种元素,“固氮”在工农业生产中有着重要作用,是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 | 大气固氮 N2(g)+O2(g)  2NO(g) 2NO(g) | 工业固氮 N2(g)+3H2(g)  2NH3(g) 2NH3(g) |
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×10-8 | 2×104 | 7×103 |
| | | | | |
(1)①分析数据可知:大气固氮反应属于___________(填“吸热”或“放热”)反应。
②在一定温度下,将一定足的N2和O2通入到体积为1L的密闭容器中,当“大气固氮”反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是_______。
a.增大压强 b.增大反应物的浓度 c.使用催化剂 d.升高温度
③ 从分子结构角度解释“大气固氮”和“工业固氮”反应的活化能都很高的原因:________。
(2)分析表格数据可知“大气固氮”的反应正向进行的程度小,不适合大规模生产,故世界各国均采用合成氨的方法进行工业固氮。
①从平衡移动角度考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
②将0.1molN2和0.1molH2通入一容积可变的容器中进行工业固氮反应,则下图所示N2的平衡转化率在不同压强(P1,P2)下随温度变化的曲线正确的是____________(填“A” 或“B”);比较P1、P2的大小关系________;若300℃、压强P2时达到平衡,容器容积恰为100L,则此状态下反应的平衡常数K=______________ (计算结果保留2位有效数字)。
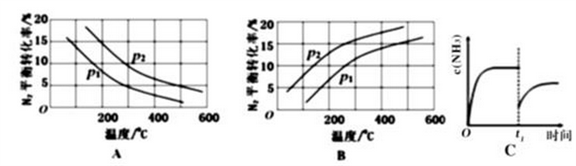
③合成氨反应达到平衡后,t1时刻氨气浓度欲发生图C变化可采取的措施是____________。
(3)近年近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g),则其反应热△H=____________。
(已知:N2(g)+3H2(g)⇌2NH3(g) △H1=-92.4kJ•mol-1;2H2(g)+O2(g)⇌2H2O(l) △H2=-571.6kJ•mol-1 )
-
氮是地球上含量丰富的一种元素,“固氮”在工农业生产中有着重要作用,是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 | 大气固氮 N2(g)+O2(g)  2NO(g) 2NO(g) | 工业固氮 N2(g)+3H2(g)  2NH3(g) 2NH3(g) |
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×10-8 | 2×104 | 7×103 |
| | | | | |
(1)①分析数据可知:大气固氮反应属于_______(填“吸热”或“放热”)反应。
②在一定温度下,将一定足的N2和O2通入到体积为1L的密闭容器中,当“大气固氮”反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是_______。
a.增大压强 b.增大反应物的浓度 c.使用催化剂 d.升高温度
③ 从分子结构角度解释“大气固氮”和“工业固氮”反应的活化能都很高的原因:__________________。
(2)分析表格数据可知“大气固氮”的反应正向进行的程度小,不适合大规模生产,故世界各国均采用合成氨的方法进行工业固氮。
①从平衡移动角度考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
②将0.1molN2和0.1molH2通入一容积可变的容器中进行工业固氮反应,则下图所示N2的平衡转化率在不同压强(P1,P2)下随温度变化的曲线正确的是_(填“A” 或“B”);比较P1、P2的大小关系__________;若300℃、压强P2时达到平衡,容器容积恰为100L,则此状态下反应的平衡常数K=__________(计算结果保留2位有效数字)。

③合成氨反应达到平衡后,t1时刻氮气浓度欲发生图C变化可采取的措施是__________。
(3)近年近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,
反应原理为:2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g),则其反应热△H=____________。
(已知:N2(g)+3H2(g)⇌2NH3(g) △H1=-92.4kJ•mol-1
2H2(g)+O2(g)⇌2H2O(l) △H2=-571.6kJ•mol-1 )
-
运用化学反应原理消除工业污染,保护生态环境具有非常重要的意义。
(1)采取热还原法,用碳粉可将氮氧化物还原。
已知:①N2(g)+O2(g)=2NO(g) △H=+180.6kJ·mol-1;
②C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1。
则反应C(s)+2NO(g)=CO2(g)+N2(g) △H= kJ·mol-1。
(2)在催化剂作用下,将nmolSO2与nmolCl2充入容积可变的密闭容器中,发生反应:SO2(g)+ Cl2(g)  SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示。则v(SO2)= ___ mol/min。
②此温度下,该反应的K= 。
③相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是 。
(3)利用氨水可以将SO2和NO2吸收,原理如图所示:
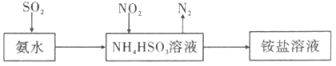
NO2被吸收的离子方程式是 。
(4)利用如下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
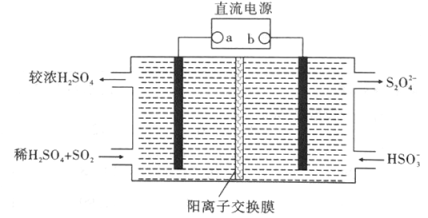
①阴极的电极反应式为 。
②在碱性条件下,用阴极排除的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应的离子方程式为 。
-
(14分)安对于工农业生产及国防等都具有重要意义。
(1)工业上以CO2和NH3为原料在一定条件下合成尿素的化学方程式为CO2(g)+2NH3(g)  CO(NH2)2|(s)+H2O(g),随温度升高,尿素的产率降低。则该反应的△H____0(填“>”或“<”);若反应体系的容积为1L,某温度下通入1molCO2和2molNH3,2min时达到平衡,H2O(g)的物质的量为0.8mol,则0~2min时间段内反应速率v(NH3)=______mol/(L·min),该反应的平衡常数可表示为K=_______。
CO(NH2)2|(s)+H2O(g),随温度升高,尿素的产率降低。则该反应的△H____0(填“>”或“<”);若反应体系的容积为1L,某温度下通入1molCO2和2molNH3,2min时达到平衡,H2O(g)的物质的量为0.8mol,则0~2min时间段内反应速率v(NH3)=______mol/(L·min),该反应的平衡常数可表示为K=_______。
(2)合成氨的原料之一为氢气,以天然气为原料制备氢气的原理如下:
CH4(g)+H2O(g)=CO(g)+3H2(g) △H>0
下列措施一定能使平衡体系中氢气百分含量增大的是______
A.升高温度 B.增大水蒸气浓度 C.加入催化剂 D.减小压强
(3)T℃时,将1molCO和H2的混合气体与0.2molH2O(g)混合,发生反应CO(g)+H2O(g) CO2(g)+H2(g) △H<0,得到1.18molCO、CO2和H2的混合气体,测得CO的转化率为90%,则原混合气体中CO和H2的体积比为_______,若容器的容积为2L,该温度下平衡常数K=_______。
CO2(g)+H2(g) △H<0,得到1.18molCO、CO2和H2的混合气体,测得CO的转化率为90%,则原混合气体中CO和H2的体积比为_______,若容器的容积为2L,该温度下平衡常数K=_______。
(4)在恒容密闭容器中发生反应CO(g)+H2O(g) CO2(g)+H2(g) △H<0。已知c(H2)随反应时间t的变化如图甲中曲线I所示。若起始时容器的容积是上述密闭容器的1/2,其他条件不变,请在图甲中画出c(H2)随反应时间t的变化曲线II。
CO2(g)+H2(g) △H<0。已知c(H2)随反应时间t的变化如图甲中曲线I所示。若起始时容器的容积是上述密闭容器的1/2,其他条件不变,请在图甲中画出c(H2)随反应时间t的变化曲线II。

(5)图乙是在一定温度和压强下合成氨反应中H2和N2的起始物质的量之比与NH3平衡体积分数的关系。图中a点的横坐标为______;若按此网站的量之比投料,达到平衡时N2的体积分数为14.5%,则a点的纵坐标为______。
-
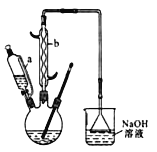
己二酸( )是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
)是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
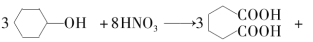 8NO↑+7H2O
8NO↑+7H2O
可能用到的有关数据如下:
| 物质 | 密度(20 ℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962 g·cm-3 | 25.9 ℃ | 160.8 ℃ | 20 ℃ 时水中溶解度 3.6 g,可混溶于乙醇、苯 | 100 |
| 己二酸 | 1.36 g·cm-3 | 152 ℃ | 337.5 ℃ | 在水中的溶解度:15 ℃ 时1.44 g,25 ℃ 时 2.3 g,易溶于乙醇,不溶于苯 | 146 |
实验步骤如下:Ⅰ.在三口烧瓶中加入 16 mL 50%的硝酸(密度为 1.31 g·cm-3),再加入1~2粒沸石,滴液漏斗中盛放有 5.4 mL 环己醇。Ⅱ.水浴加热三口烧瓶至 50 ℃ 左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60~65 ℃ 之间。Ⅲ.当环己醇全部加入后,将混合物用80~90 ℃ 水浴加热约 10 min(注意控制温度),直至无红棕色气体生成为止。Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。Ⅴ.粗产品经提纯后称重为 5.7 g。
请回答下列问题:
(1)仪器b的名称为___________________________________________________。
(2)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则,可能造成较严重的后果,试列举一条可能产生的后果:_______________________。
(3)已知用NaOH溶液吸收尾气时发生的相关反应方程式为2NO2+2NaOH===NaNO2+NaNO3+H2O,NO+NO2+2NaOH===2NaNO2+H2O。如果改用纯碱溶液,吸收尾气时也能发生类似反应,则相关反应方程式为________ 、_____________。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和________洗涤晶体。
(5)粗产品可用________ 法提纯(填实验操作名称)。本实验所得到的己二酸产率为________。














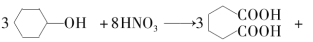 8NO↑+7H2O
8NO↑+7H2O