-
铜及其化合物在日常生活中应用广泛。某研究性学习小组欲从氯化铁溶液腐蚀印刷电路极后的酸性废液中(含FeCl3、FeCl2含CuCl2)制备氯化铜晶体(CuCl2·2H2O),设计路线如下:
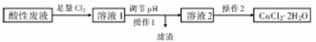
回答下列问题:
(1)检验酸性废液中含有Fe3+,常用的试剂是 (填化学式);酸性废液中加入足量Cl2,反应的化学方程式为 。
(2)操作1的名称是 ;调节溶液的pH时适宜选用下列试剂中的 ;
A.NaOH溶液 B.Na2CO3 C.氨水 D.CuO
若调节溶液的pH为4时,溶液中残留的Fe3+物质的量浓度为 (已知25℃时,Kap[Fe(OH)3]=4×10-38).
(3)操作2需在氯化氢气流中经过加热浓缩、 、过滤、洗涤、干燥。在氯化氢气流中进行操作的原因是 (结合离子方程式并简要说明)。
(4)若在溶液2中通入一定量的SO2,加热,则生成CuCl沉淀,该反应的离子方程式为 。
(5)该小组设想以铜棒和石墨棒为电极,以KI溶液为电解液,利用电解来制取碘化亚铜,
已知:2Cu2++4I-=2CuI↓+I2.若按其设想,铜棒应连接电源的 (填“正”或“负”)极;阴极发生的电极反应式为 。
-
(Ⅰ)铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)固体A用稀盐酸溶解的原因是______;
(2)检验溶液B中是否存在Fe3+的方法是______;
(3)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是______ 2CuCl↓+SO42-+2H+
-
(Ⅰ)铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)固体A用稀盐酸溶解的原因是________;
(2)检验溶液B中是否存在Fe3+的方法是________;
(3)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是________;
(Ⅱ)(1) 常温下,某同学将稀盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | 氨水物质的量浓度 (mol·L-1) | 盐酸物质的量浓度 (mol·L-1) | 混合溶液 pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | C | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH>7 |
请回答:从第①组情况分析,该组所得混合溶液中由水电离出的c(H+)=________mol·L-1;从第②组情况表明,C ________0.2 mol·L-1(选填“>”、“<”或“=”);从第③组情况分析可知,混合溶液中c(NH4+)
________c(NH3·H2O)(选填“>”、“<”或“=”)。
(2)写出以下四组溶液NH4+离子浓度由大到小的顺序________> ________> ________>________(填选项编号)。
A.0.1mol·L-1NH4Cl
B.0.1mol·L-1NH4Cl和0.1mol·L-1NH3·H2O
C.0.1mol·L-1NH3·H2O
D.0.1mol·L-1NH4Cl和0.1mol·L-1HCl
-
Ⅰ.铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)固体A用稀盐酸溶解的原因是 __。
(2)检验溶液B中是否存在Fe3+的方法是 __。
(3)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是 。
Ⅱ.常温下,某同学将稀盐酸和氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | 氨水物质的量浓度/(mol·L-1) | 盐酸物质的量浓度/(mol·L-1) | 混合溶液pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH>7 |
请回答:
(4)从第①组情况分析,该组所得混合溶液中由水电离出的c(H+)= __mol·L-1;从第②组情况表明,c __(填“>”“<”或“=”)0.2 mol·L-1;从第③组情况分析可知,混合溶液中c(NH4+) __(填“>”“<”或“=”)c(NH3·H2O)。
(5)写出以下四组溶液NH4+浓度由大到小的顺序 __> __> __> __(填选项编号)。
A.0.1 mol·L-1 NH4Cl
B.0.1 mol·L-1 NH4Cl和0.1 mol·L-1 NH3·H2O
C.0.1 mol·L-1 NH3·H2O
D.0.1 mol·L-1 NH4Cl和0.1 mol·L-1 HCl
-
铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜 含杂质
含杂质 与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
 溶液B经过________、__________、___________可得到氯化铜晶体;
溶液B经过________、__________、___________可得到氯化铜晶体;
 检验溶液B中是否存在
检验溶液B中是否存在 的方法是_________;
的方法是_________;
 下列物质适合于调节溶液的pH得溶液B的是________
下列物质适合于调节溶液的pH得溶液B的是________
A.NaOH溶液 
 氨水
氨水 
 已知元素在高价态时常表现氧化性,若在酸性
已知元素在高价态时常表现氧化性,若在酸性 溶液中加入一定量的
溶液中加入一定量的 和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是____________
和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是____________
-
某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路(已知发生的反应为:2FeCl3 Cu → 2FeCl2
Cu → 2FeCl2 CuCl2)。课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 8.61g。(2)另取10mL废液放入铜片充分反应,铜片质量减少了0.256g。下列关于原废液及其形成的判断正确的是
CuCl2)。课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 8.61g。(2)另取10mL废液放入铜片充分反应,铜片质量减少了0.256g。下列关于原废液及其形成的判断正确的是
A.c( )︰c(
)︰c( )
)
B.c( )︰c(
)︰c( )
)
C.c( )
) 6mol/L,c(
6mol/L,c( )
) 0.6mol/L
0.6mol/L
D.该绝缘板腐蚀后质量减少0.384g
-
印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用.
(1)测得某废腐蚀液中含CuCl2 1.5mol•L-1、FeCl23.0 mol•L-1、FeCl3 1.0mol•L-1、HCl3.0mol•L-1.取废腐蚀液200mL按如下流程在实验室进行实验:
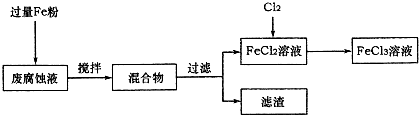
回答下列问题:
①废腐蚀液中加入过量铁粉后,发生反应的离子方程式为________;
②检验废腐蚀液中含有Fe3+的实验操作是________;
在上述流程中,“过滤”用到的玻璃仪器有烧杯、玻璃棒、________.
③由滤渣得到纯铜,除杂所需试剂是________.
(2)某化学兴趣小组利用如图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液.
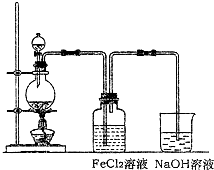
①实验开始前,某同学对实验装置进行了气密性检查,方法是________.
②浓盐酸与二氧化锰反应的化学方程式为________;
烧杯中NaOH溶液的作用是________.
③参考(1)中数据,按上述流程操作,需称取Fe粉的质量应不少于________g,需通入Cl2的物质的量应不少于________mol.
-
印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用.测得某废腐蚀液中含CuCl2 1.5mol•L-1、FeCl2 3.0mol•L-1、FeCl3 1.0mol•L-1、HCl 3.0mol•L-1.取废腐蚀液200mL按如下流程在实验室进行实验:
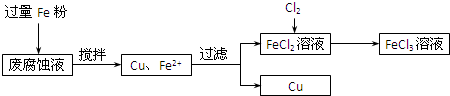
回答下列问题:
(1)在上述流程中,“过滤”用到的玻璃仪器:普通漏斗、玻璃棒、______;用上述方法获得的铜粉中含有杂质,除杂所需试剂是______(填化学式).
(2)实验室可用浓盐酸和固体KMnO4直接反应制备Cl2.此反应的离子方程式为______.此反应中体现了盐酸的______性质.利用图1制备Cl2并通入到FeCl2溶液中获得FeCl3溶液.

请从图2中挑选所需的仪器,完成图1装置简图(可添加必要的塞子、玻璃导管、胶皮管.不画固定装置),并标明容器中所装试剂名称.
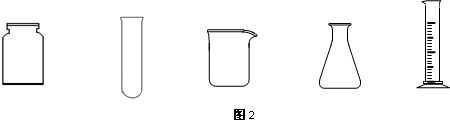
(3)按上述流程操作,需称取Fe粉的质量应不少于______g,需通入Cl2的物质的量不少于______mol.
-
(16分)印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。
(1)测得某废腐蚀液中含CuCl2 1.5 mol·L-1、FeCl23.O mol·L-1、FeCl3 1.0 mol·L-1、HCl3.0 mol·L-1。取废腐蚀液200mL按如下流程在实验室进行实验:
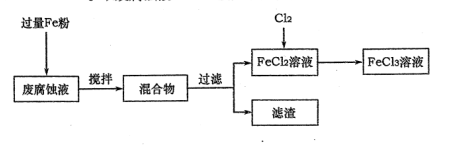
回答下列问题:
① 废腐蚀液中加入过量铁粉后,发生反应的离子方程式为________ 。
② 检验废腐蚀液中含有Fe3+的实验操作是________;
在上述流程中,“过滤”用到的玻璃仪器有烧杯、玻璃棒、________。
③由滤渣得到纯铜,除杂所需试剂是 ________ 。
(2)某化学兴趣小组利用下图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液。
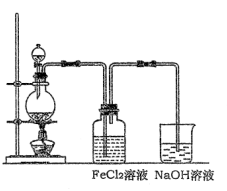
①实验开始前,某同学对实验装置进行了气密性检查,方法是________。
②浓盐酸与二氧化锰反应的化学方程式为;
烧杯中NaOH溶液的作用是 ________ 。
③参考(1)中数据,按上述流程操作,需称取Fe粉的质量应不少于________g,
需通入Cl2的物质的量应不少于________mol.
-
印刷电路的废腐蚀液中含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。
(1)测得某废腐蚀液中含CuCl2 1.5 mol·L-1、FeCl2 3.0 mol·L-1、FeCl3 1.0 mol·L-1、HCl 3.0 mol·L-1。
取废腐蚀液200 mL按如下流程在实验室进行实验:
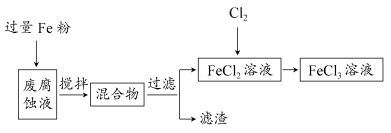
回答下列问题:
①废腐蚀液中加入过量铁粉后,发生反应的离子方程式为________。
②检验废腐蚀液中含有Fe3+的实验操作是________;在上述流程中,“过滤”用到的玻璃仪器有烧杯、玻璃棒、________。
③由滤渣得到纯铜,除杂所需试剂是________。
(2)某化学兴趣小组利用下图所示装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液。

①实验开始前,某同学对实验装置进行了气密性检查,方法是________。
②浓盐酸与二氧化锰加热反应的化学方程式为________;烧杯中NaOH溶液的作用是________。
③参考(1)中数据,按上述流程操作,需称取Fe粉的质量应不少于________g,需通入Cl2的物质的量应不少于________ mol。









