-
化学学习小组为测定某补血剂中硫酸亚铁的含量进行了以下探究:
【查阅资料】本品为糖衣片,除去糖衣后显淡蓝绿色,主要成分为FeSO4·7H2O。
【实验步骤】取本品10片,在适当的条件下配成100 mL溶液,分别准确量取20 mL溶液,用下列两种方法进行实验:
方法①:用一定物质的量浓度的酸性高锰酸钾溶液滴定。
方法②:加过量H2O2溶液,然后再加入过量NaOH溶液,得红褐色沉淀,将沉淀过滤并充分加热得红棕色固体,称量该固体的质量。
请回答下列问题:
(1)方法①中,配制100mL一定物质的量浓度的酸性高锰酸钾溶液时,所需要的玻璃仪器除量筒、玻璃棒、胶头滴管、烧杯外还有______________。
(2)方法②中,加过量H2O2溶液的目的是_____________,所得红褐色沉淀是__________(填化学式,下同),红棕色固体是__________。
(3)有同学认为可以将方法②中的H2O2换成氯气,与使用氯气相比,用H2O2溶液的好处是______________________。
(4)在方法①中,若每消耗1 mL酸性高锰酸钾溶液相当于0.152 g FeSO4,则该溶液中高锰酸钾的物质的量浓度是__________。在方法②中,若称得红棕色固体的质量为a g,则每片补血剂含FeSO4_________________g。
高二化学实验题中等难度题查看答案及解析
-
(12分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组拟用KMnO4溶液滴定的方法,测定该补血剂中铁元素的含量,进行了如下实验:
[查阅资料]
在酸性条件下,用KMnO4标准溶液进行氧化还原滴定,可以测定Fe2+的含量。反应的离子方程式是:Fe2++MnO4-+H+ —— Fe3++Mn2++H2O(未配平)
[准备实验用品]
①仪器:a.电子天平,b.滴定管,c.100mL量筒,d.烧杯,e.漏斗,f.250mL容量瓶,g.锥形瓶,h.玻璃棒,i.药匙,j.烧瓶,k.铁架台(带滴定管夹),l.胶头滴管。
②试剂:a.硫酸亚铁补血剂药片,b.高锰酸钾晶体,c.酚酞溶液,d.KSCN溶液,
e.稀硫酸,f.稀盐酸,g.蒸馏水。
[实验步骤]
①称取0.474 g KMnO4晶体,配成250.00 mL水溶液;
②取5片除去糖衣(非还原糖)后的硫酸亚铁补血剂药片(1.500 g),研细后加稀硫酸溶解,配成100.00 mL水溶液。
③用酸式滴定管取待测“补血剂”溶液20.00mL于某容器中。
④盛装标准KMnO4溶液,静置后,读取数据,记录为KMnO4标准溶液体积的初读数。
⑤滴定,并记录KMnO4标准溶液的终读数。再重复滴定2次。
[实验记录]
滴定次数
实验数据
1
2
3
V(样品)/mL
20.00
20.00
20.00
V(KMnO4)/mL(初读数)
0.00
0.20
0.00
V(KMnO4)/mL(终读数)
15.85
15.22
14.98
[交流与讨论]
(1)准备的实验用品中,不需要的仪器有(填序号)________;不需要的试剂有(填序号)________。
(2)本实验所用的KMnO4标准溶液的物质的量浓度为________。
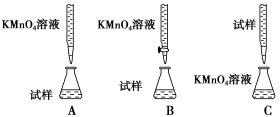
(3)课外小组里有位同学设计了下列四种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得共识,认为最合理的是________(填字母序号)。
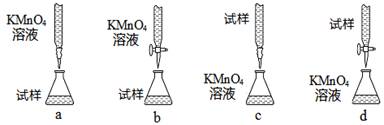
(4)判断滴定终点的依据是________。
(5)根据实验数据,计算该补血剂中铁元素的含量 。
高二化学实验题简单题查看答案及解析
-
为测定该补血剂样品[主要成分是硫酸亚铁晶体(FeSO4·7H2O)]中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一:用酸性KMnO4溶液滴定测定铁元素的含量
(1)写出滴定反应的离子方程式 .
(2)下列滴定方式中,最合理的是 (夹持部分略去)(填字母序号).
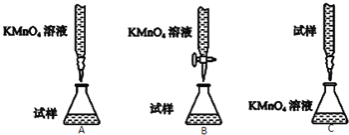
(3)实验前,首先要准确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 (填仪器名称).
方案二 将FeSO4转化为Fe2O3,测定质量变化操作流程如下:

(4)步骤②中除用H2O2外还可以使用的物质是 .
(5)步骤②是否可以省略 ,理由是 .
(6)步骤④中一系列操作依次是:过滤、洗涤、 、冷却、称量.
(7)假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示).
高二化学实验题简单题查看答案及解析
-
中学化学常见的滴定法包括中和滴定法、氧化还原反应滴定法等。
(1)探究小组甲用酸性KMnO4溶液滴定某补血剂[主要成分硫酸亚铁晶体(FeSO4•7H2O)]中铁元素的含量。
①下列滴定装置中(夹持部分略去),最合理的是:__________(填字母序号)。
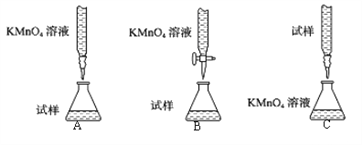
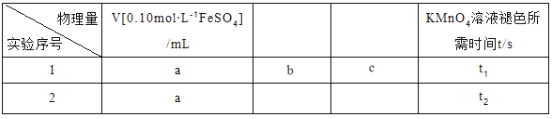
②该小组拟在同浓度的FeSO4溶液中,探究酸性KMnO4溶液浓度对Fe2+被氧化时反应速率的影响。限选试剂与仪器:0.10mol∙L-1FeSO4、0.02mol∙L-1酸性KMnO4、蒸馏水、锥形瓶、试管、胶头滴管、量筒、秒表。参照下表格式,完成实验表格(列出所选试剂体积和数据;数据用字母表示)。_____________、_____________、_____________、_____________。
(2)常温下,探究小组乙将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液的pH随加入盐酸体积的变化曲线如图所示。
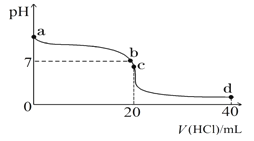
①a点处假设溶液的pH=10,则该点处由水电离产生的c(OH-)=__________________。
②取c点时的饱和溶液并向其加入水玻璃(硅酸钠水溶液),振荡、静置。写出实验现象并用必要的文字和相关离子方程式给予解释:___________________________________。
③d点所示溶液中离子浓度由大到小的排序是_______________________________。
高二化学实验题中等难度题查看答案及解析
-
中学化学常见的滴定法包括中和滴定法、氧化还原滴定法等。
I.(1)探究小组甲用酸性KMnO4溶液滴定某补血剂[主要成分硫酸亚铁晶体(FeSO4•7H2O)]中铁元素的含量。
①下列滴定装置中(夹持部分略去),最合理的是: (填字母序号)。
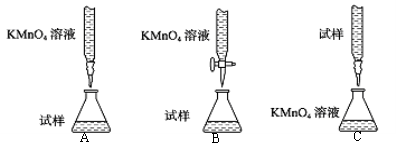
②实验前,首先要准确配制一定物质的量浓度的酸性KMnO4溶液250mL,配制时需要的仪器除托盘天平、药匙、玻璃棒、烧杯、量筒外,还需要 (填仪器名称)。
Ⅱ.探究小组乙测定NH3•H2O的浓度及电离平衡常数Kb
常温下,探究小组量取25.00mL氨水至锥形瓶中,用0.0500 mol•L-1HCl滴定。用pH计采集数据, 溶液的pH随加入盐酸体积的变化曲线如图所示。
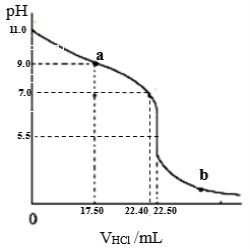
(2)如图:a>7.0的理由是(用电离方程式表示) 。
(3)如图,当加入稀盐酸的体积为22.40mL时,此时溶液中c(Cl—) c(NH4+)(填<、>或=)。
当加入稀盐酸的体积至b点溶液中离子浓度大小关系为_________。
(4)结合图信息,计算氨水的浓度为 mol•L-1;写出NH3•H2O电离平衡常数Kb的表达式,Kb= 。
(5)关于该滴定实验的说法中,正确的是 。
A. 锥形瓶中有少量蒸馏水不影响测定结果
B. 锥形瓶未用氨水进行润洗会导致测得氨水的浓度偏低
C. 酸式滴定管未用盐酸润洗会导致测得氨水的浓度偏高
D. 滴定终点时俯视读数会导致测得氨水的浓度偏高
高二化学实验题困难题查看答案及解析
-
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
Ⅰ、将
g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2
2Fe2O3+8SO2
Ⅱ、反应结束后,将乙瓶中的溶液进行如图2所示处理。
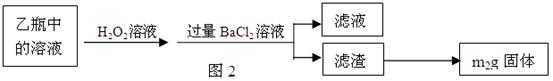
[实验二]测定铁元素的含量。
Ⅲ、测定铁元素含量的实验步骤如图3所示:

问题讨论:
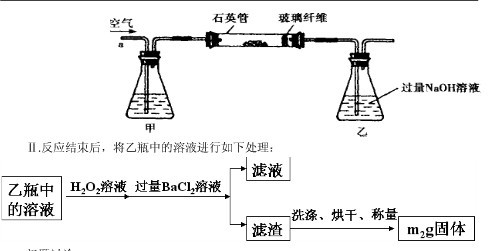
(1)Ⅰ中,甲瓶内所盛试剂是________溶液。乙瓶内发生反应的离子方程式有:
________、________。
(2)Ⅱ中的滤渣在称量前还应进行的操作是。
(3)Ⅱ中,所加H2O2溶液(氧化剂)需足量的理由是________。
(4)Ⅲ的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有________。
写出④中反应的离子方程式________。
(5)该黄铁矿中硫元素的质量分数为________。
高二化学实验题简单题查看答案及解析
-
(10分)黄铁矿(主要成分为FeS2)曾是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
I.将m1 g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O22Fe2O3+8SO2
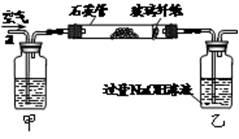
II.反应结束后,将乙瓶中的溶液进行如下图所示处理。

[实验二]测定铁元素的含量。
III.测定铁元素的含量的实验步骤如下图所示。

问题讨论:
(1)上述装置中,甲瓶内所盛试剂是________溶液。
(2)向乙瓶溶液中滴加H2O2溶液时,发生氧化还原反应的离子方程式为________。
II中除了可以用H2O2溶液作为氧化剂,还可以加入________(填序号)。
①氯水 ②浓H2SO4 ③HNO3 ④Fe2(SO4)3
(3)该黄铁矿中硫元素的质量分数为________。
(4)III的步骤②中,若选用铁粉作还原剂,你认为合理吗?并说明理由。(如合理,则此空不填)________(填“合理“或”不合理“)、________(如合理,则此空不填)。
(5)若要测定铁元素的含量,则步骤III中还需要测定的数据有________。
高二化学实验题中等难度题查看答案及解析
-
化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行探究:
Ⅰ.查资料:该摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸无气体生成.
Ⅱ.牙膏样品中碳酸钙的定量测定:
利用图所示装置(图中夹持仪器略去)进行实验,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数.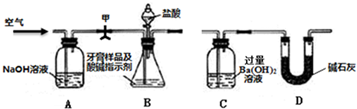
实验步骤:
①如图所示连接好装置,先检查装置的气密性;
②准确称取牙膏样品的质量4.00g,并在各仪器中加入相应试剂;
③打开弹簧夹甲,缓缓通入空气,然后接上C;
④打开B的分液漏斗滴加盐酸反应,同时再次持续缓缓通入空气;
⑤待B中不再产生气体后停止滴加盐酸;
⑥将C中沉淀过滤、洗涤、干燥,得BaCO3固体,称量BaCO3的质量为1.97g.
(1)A中放NaOH溶液的作用是______;
(2)步骤④通入空气的作用是______;
(3)步骤⑥中检验沉淀洗干净的方法是______;
(4)本实验测定得到的样品中碳酸钙的质量分数为______;
若采取下列措施,对测定结果的准确度没有影响的是______(填标号);
a.省略步骤③b.滴加盐酸快一些 c.多次实验,取平均值计算
(5)有同学认为不必测定C中生成BaCO3质量,只要测定装置C在吸收CO2前后质量差,一样可以准确测定碳酸钙质量分数.请说明是否可以并说明理由______.高二化学解答题中等难度题查看答案及解析
-
(6分)右图是某厂生产的一盒氢氧化铝片标签的部分内容,据此回答以下问题:
氢氧化铝片
Aluminium Hydroxide Tablets
【主要成分】糖衣、碳酸镁、氢氧化铝、淀粉
【适应症】能缓解胃酸过多
【用法用量】成人:口服,一次0.6~0.9g(一次2~3片),一日3次,餐前1小时服。
【详细用法】见说明书
(1)该药的有效成分是_______________;
(2)写出该药中的一种有效成分发挥功效时的离子方程式____________________ ; (3)若此药每片含碳酸镁 420mg、氢氧化铝 195mg,取一片这种药片碾碎后与足量的0.1mol/l盐酸反应,则生成的气体在标准状况下的体积是_______________毫升。
高二化学填空题简单题查看答案及解析
-
Ⅰ:硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一 滴定法 用酸性KMnO4溶液滴定测定铁元素的含量。
反应原理:5Fe2++MnO+8H+===5Fe3++Mn2++4H2O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需_________________(填仪器名称)。
(2)某同学设计的下列滴定方式中,最合理的是___________(夹持部分略去)(填字母序号)。
方案二 重量法 操作流程如下:
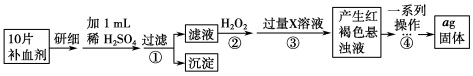
(3)若省略步骤②,则加入过量X溶液后会产生白色沉淀,请写出该沉淀在空气中变质的方程式:______________________________________________。
(4)步骤④中一系列操作依次是:过滤、洗涤、灼烧、冷却、称量。
II:六水合硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小。实验室中常以废铁屑为原料来制备,其步骤如下:
图1
图2
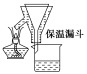
步骤1:铁屑的处理。将废铁屑放入热的碳酸钠溶液中浸泡几分钟后,用图1所示的倾析方法分离出固体并洗涤、干燥。
步骤2:FeSO4溶液的制备。向锥形瓶中加入30mL的3 mol·L-1H2SO4溶液,再加入过量的铁屑,加热至充分反应为止。趁热过滤(如图2所示),收集滤液和洗涤液。
步骤3:六水合硫酸亚铁铵的制备。向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,所得溶液经过一系列操作、洗涤后得到六水合硫酸亚铁铵晶体。
请回答下列问题:
(1)趁热过滤的目的和理由是________________________________________________。
(2) ①步骤3中的一系列操作包括:_________________________________。
②洗涤硫酸亚铁铵晶体最好用什么试剂:_________________________________。
高二化学实验题困难题查看答案及解析