-
有色金属行业发展蕴藏着巨大潜力。目前,全世界消费量排在前五位的为铜、铝、铅、锌、镍。回答下列问题。
(1)铜原子的电子占有________种能量不同的原子轨道;在元素周期表中铝和铅元素处于周期表的_____区。
(2)配合物分子内(如图)的化学键有____________(填序号)。
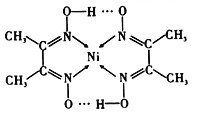
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH CH、③苯、④HCHO等,其中分子中C原子为sp杂化的有___________(填物质序号);预测σ键与π键比值为3∶1的分子的立体结构为_______________形。
CH、③苯、④HCHO等,其中分子中C原子为sp杂化的有___________(填物质序号);预测σ键与π键比值为3∶1的分子的立体结构为_______________形。
(4)硫酸锌是最重要的锌盐,为无色斜方晶体或白色粉末,其七水合物(ZnSO4·7H2O) 俗称皓矾,是一种天然矿物。请在SO42-的立体结构图(如图)中,描画出氧原子(用实心圆点“ ”表示)和硫原子(用空心圆点“O”表示)的位置。_____________
”表示)和硫原子(用空心圆点“O”表示)的位置。_____________
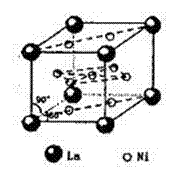
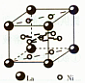
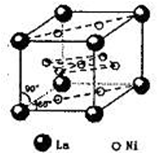
(5)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。
①下列关于该贮氢材料及氢气的说法,正确的是__________(填序号)。
A.该材料中镧原子和镍原子之间存在化学键,是原子晶体
B.已知镧和镍的第一电离能分别为5.58eV、7.64eV,可见气态镧原子比气态镍原子更容易变成+1价的气态阳离子
C.氢分子被吸收时首先要在合金表面解离变成氢原子,同时放出热量
D.该材料贮氢时采用常温高压比采用常温常压更好
E.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
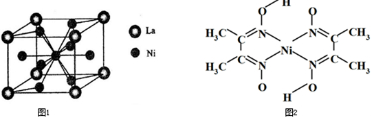
②该合金的晶胞如图所示,属六方晶系,底面夹角为60°(120°),经测定晶胞参数a=511pm,c=397pm,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上,该晶体的化学式为_______________。若每个晶胞可吸收3个H2,则储氢后(氢进入晶胞空隙,体积不变)该晶胞的密度计算式为___________________________。(NA表示阿伏加德罗常数)

-
金属镍及其化合物在合金材料以及催化剂等方面应用广泛.目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位,镍行业发展蕴藏着巨大的潜力.
(1)基态Ni原子的核外电子排布式为______.
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式为______.
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应.如①CH2=CH2、②HC≡CH、③ 、④HCHO等,其中碳原子采取sp2杂化的分子有______(填物质序号),预测HCHO分子的立体结构为______形.
、④HCHO等,其中碳原子采取sp2杂化的分子有______(填物质序号),预测HCHO分子的立体结构为______形.
(4)NiO的晶体结构类型与氯化钠的相同,NiO晶胞中Ni和O的配位数分别为______;Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO______ FeO(填“<”或“>”);
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示.该合金的化学式为______;
(6)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示.该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键______.
-
(15分)目前,全世界的镍消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大的潜力。镍化合物中的三氧化二镍是一种重要的电子元件材料和二次电池材料。工业上可利用含镍合金废料(除镍外,还含有Fe、Cu、Ca、Mg、C等杂质)制取草酸镍,然后高温煅烧草酸镍来制取三氧化二镍。
已知:①草酸的钙、镁、镍盐均难溶于水,且溶解度:NiC2O4> NiC2O4·H2O> NiC2O4·2H2O
②常温下,Ksp[(Fe(OH))3]=4.0×10-38,lg5=0.7
根据下列工艺流程图回答问题:
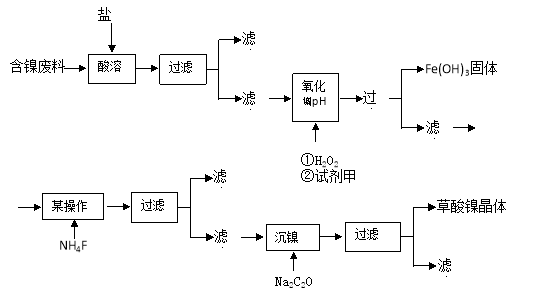
(1)加6%的H2O2时,温度不能太高,其目的是 。若H2O2在一开始酸溶时便与盐酸一起加入,会造成酸溶过滤后的滤液中增加一种金属离子,用离子方程式表示这一情况 。
(2)流程中有一步是调pH,使Fe3+转化为Fe(OH)3沉淀,常温下当溶液中c (Fe3+)=0.5×10-5mol/L时,溶液的pH= 。
(3)流程中加入NH4F的目的是 。
(4)将最后所得的草酸镍晶体在空气中强热到400℃,可生成三氧化二镍和无毒气体,写出该反应的化学方程式 。
(5)工业上还可用电解法制取三氧化二镍,用NaOH溶液调节NiCl2溶液的pH至7.5,再加入适量Na2SO4进行电解,电解产生的Cl2其80%的可将二价镍氧化为三价镍。写出Cl2氧化Ni(OH)2生成三氧化二镍的离子方程式 ;将amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量是 。
(6)近年来镍氢电池发展很快,它可由NiO(OH)跟LaNi5H6(LaNi5H6中各元素化合价均可看作是零)组成:6NiO(OH)+LaNi5H6  LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。
LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。
-
[化学选考-----物质结构与性质](13分)
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于________晶体;基态Ni原子的电子排布式为________。
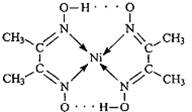 (2)配合物 分子内的作用力有________(填编号)。
(2)配合物 分子内的作用力有________(填编号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如
①CH2=CH2、②CH≡CH、③ 、④HCHO等,其中分子属于平面结构的有________(填物质序号),
预测HCHO分子的立体结构为________形。
(4)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如右图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上。该晶体的化学式为________。
-
(12分)目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
(1)配合物Ni(CO)4常温为液态,易溶于CC14、苯等有机溶剂。固态Ni(CO)4
属于____晶体,基态Ni原子的电子排布式为________;
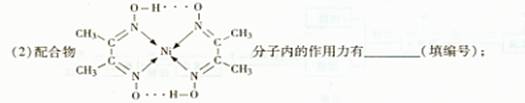
A.氢键 B.离子键 C.共价键 D.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③ 等,其中碳原子采取sp2杂化的分子有________(填物质序号),预测HCHO
等,其中碳原子采取sp2杂化的分子有________(填物质序号),预测HCHO
分子的立体结构为________形;
(4)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。 该合金的晶胞如右图所示,晶胞中心有一个镍原子,其他镍原子都在晶
胞面上,镧原子都在晶胞顶点。则该晶体的化学式为________。
-
(13分)目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于________晶体;基态Ni原子的电子排布式为________。
(2)配合物分子内的作用力有________(填编号)。
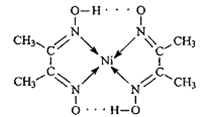
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如
①CH2=CH2、②CH≡CH、③苯、④HCHO等,
其中分子属于平面结构的有________(填物质序号),预测HCHO分子的立体结构为________形。
(4)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上。该晶体的化学式为________。
-
镍及其化合物在工业生产中有着广泛的运用,当前世界上镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。回答下列问题:
(1)镍元素在元素周期表中位于__________,在基态镍原子中,其核外电子有_______种不同运动状态,M层电子排布式为______________________。
(2)在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示。在该结构中,氮镍之间形成的化学键是__________,碳原子的杂化轨道类有_______________,非金属元素的电负性由大到小的顺序是_________________。

(3)过渡金属原子可以与CO分子形成配合物,配合物价电子总数符合18电子规则。如Cr可以与CO形成Cr(CO)6分子:价电子总数(18) =Cr的价电子数(6)+CO提供电子数(2×6)。Ni原子与CO形成配合物的化学式为______________。该配合物常温下为液态,易溶于CCl4、苯等有机溶剂,据此判断该分子属于____________分子(填“极性”或“非极性”)。
(4)甲醛在Ni催化作用下加氢可得甲醇。甲醇分子内的O-C-H键角_____________(填“大于”、“等于”或“小于”)甲醛分子内的O-C-H键角;甲醇易溶于水的原因是______________。
(5)NixO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为a pm.晶胞中两个Ni原子之间的最短距离为_______pm。若晶体中的Ni离子分别为Ni2+、Ni3+,此晶体中Ni2+与Ni3+的最简整数比为____________。
-
N和S是重要的非金属元素,聚氮化硫(SN)x是重要的超导材料,目前己成为全球材料行业研究的热点。回答下列问题:
(1)下列电子排布图能表示氮原子的最低能量状态的是_____(填字母)。
A. B.
B.
C.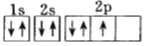 D.
D.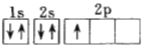
(2)S原子的基态原子核外有____个未成对电子,有__________种不同形状的电子云。
(3) S、N、O三种元素的第一电离能由大到小的顺序为________,列举一种与SCN-互为等电子体的分子为_______。
(4) (CH3)3N中N原子杂化方式为_______;As与N是同主族元素,AsH3的相对分子质量比NH3大,实验测得AsH3沸点比NH3低,其原因是___________。
(5) GaN是一种重要的半导体材料,其晶胞结构和金刚石类似,其晶胞结构如图。
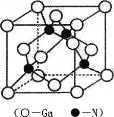
①氮化镓中氮原子与镓原子之间以_______键相结合,与同一个Ga原子相连的N原子构成的空间构型为_______。
②GaN晶体的晶胞边长为a pm,摩尔质量为M g/mol,阿伏加德罗常数的值为NA,则GaN晶体的密度为_______g•cm-3 (只要求列算式,不必计算出结果,1pm=l0-12m)。
-
N和S是重要的非金属元素,聚氮化硫(SN)x是重要的超导材料,目前己成为全球材料行业研究的热点。回答下列问题:
(1)下列电子排布图能表示氮原子的最低能量状态的是_____(填字母)。
A.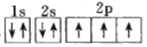 B.
B.
C.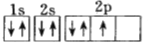 D.
D.
(2)S原子的基态原子核外有____个未成对电子,有__________种不同形状的电子云。
(3) S、N、O三种元素的第一电离能由大到小的顺序为________,列举一种与SCN-互为等电子体的分子为_______。
(4) (CH3)3N中N原子杂化方式为_______;As与N是同主族元素,AsH3的相对分子质量比NH3大,实验测得AsH3沸点比NH3低,其原因是___________。
(5) GaN是一种重要的半导体材料,其晶胞结构和金刚石类似,其晶胞结构如图。

①氮化镓中氮原子与镓原子之间以_______键相结合,与同一个Ga原子相连的N原子构成的空间构型为_______。
②GaN晶体的晶胞边长为a pm,摩尔质量为M g/mol,阿伏加德罗常数的值为NA,则GaN晶体的密度为_______g•cm-3 (只要求列算式,不必计算出结果,1pm=l0-12m)。
-
N和S是重要的非金属元素,聚氮化硫(SN)x是重要的超导材料,目前己成为全球材料行业研究的热点。回答下列问题:
(1)下列电子排布图能表示氮原子的最低能量状态的是_____(填字母)。
A.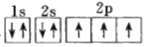 B.
B.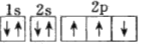
C.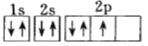 D.
D.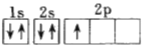
(2)S原子的基态原子核外有____个未成对电子,有__________种不同形状的电子云。
(3) S、N、O三种元素的第一电离能由大到小的顺序为________,列举一种与SCN-互为等电子体的分子为_______。
(4) (CH3)3N中N原子杂化方式为_______;As与N是同主族元素,AsH3的相对分子质量比NH3大,实验测得AsH3沸点比NH3低,其原因是___________。
(5) GaN是一种重要的半导体材料,其晶胞结构和金刚石类似,其晶胞结构如图。
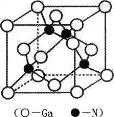
①氮化镓中氮原子与镓原子之间以_______键相结合,与同一个Ga原子相连的N原子构成的空间构型为_______。
②GaN晶体的晶胞边长为a pm,摩尔质量为M g/mol,阿伏加德罗常数的值为NA,则GaN晶体的密度为_______g•cm-3 (只要求列算式,不必计算出结果,1pm=l0-12m)。

CH、③苯、④HCHO等,其中分子中C原子为sp杂化的有___________(填物质序号);预测σ键与π键比值为3∶1的分子的立体结构为_______________形。
”表示)和硫原子(用空心圆点“O”表示)的位置。_____________




 (2)配合物 分子内的作用力有________(填编号)。
(2)配合物 分子内的作用力有________(填编号)。

 等,其中碳原子采取sp2杂化的分子有________(填物质序号),预测HCHO
等,其中碳原子采取sp2杂化的分子有________(填物质序号),预测HCHO



 B.
B.
 D.
D.

 B.
B.
 D.
D.

 B.
B.
 D.
D.
