-
合成氨在生产中具有重要意义。请按要求回答下列问题。
(1)已知反应N2(g)+3H2(g) 2NH3(g) △H<0。向恒温恒容密闭的反应容器中投料1 mol N2、3 mol H2,在不同温度下分别达平衡时,混合气中NH3的物质的量分数随压强变化的曲线如图所示:
2NH3(g) △H<0。向恒温恒容密闭的反应容器中投料1 mol N2、3 mol H2,在不同温度下分别达平衡时,混合气中NH3的物质的量分数随压强变化的曲线如图所示:
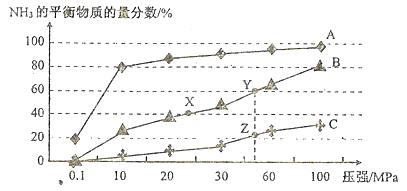
①曲线A、B、C对应的温度是由低到高依次是(填代表曲线的字母)_______。图中X、Y、Z点的平衡常数大小关系(填“>”“<”或“=”): K(X)__K(Y)_____K(Z).
②既能加快化学反应速率有能提高H2的转化率的措施有_______。
③Y点对应的H2的转化率是_______;若仅将起始投料均加倍,其他条件不变,达新平衡时,则H2的转化率将会(填“升高”、“降低”或“不变”) _______ 。
(2)电解法合成氨因其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图甲和图乙所示:
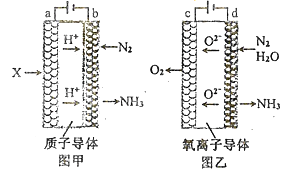
①图甲a电极上的电极反应式为_______图乙d电极上的电极反应式为_______。
②若图甲和图乙装置的通电时间相同、电流强度相等,电解效率分别为80%和60%,则两种装置中产生氨气的物质的量之比为_______。
-
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K= 。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越 。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K= (可用分数表示)。能说明该反应达到化学平衡状态的是 (填字母)。
a.容器内的密度保持不变
b.容器内压强保持不变
c.v正(N2)=2v逆(NH3)
d.混合气体中c(NH3)不变
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号) 。
-
氨是合成硝酸、铵盐和氮肥的基本原料,在科学技术和生产中有重要的应用。请回答下列问题:
(1)以N2和H2为原料,合成氨气的反应为N2(g)+3H2(g)  2NH3(g) ΔH<0,下列措施可以提高ʋ(正)的是_____________ (填序号)。
2NH3(g) ΔH<0,下列措施可以提高ʋ(正)的是_____________ (填序号)。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的NH3 d.降低温度
(2)在恒温条件下,将N2与H2按一定比例混合的气体充人一个体积可变的恒压密闭容器中,p = 5MPa,原气体体积为2L。5分钟后反应达到平衡时,n(N2)=1.0mol,n(H2)=3.0mol,n(NH3)=1.0mol,则反应速率v (N2)=_______mol/min (用单位时间物质的量变量表示化学反应速率),平衡常数Kp =________。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)在容积恒定的密闭容器中进行反应2NO(g)+O2(g)  2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是_____ (填序号)。
2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是_____ (填序号)。
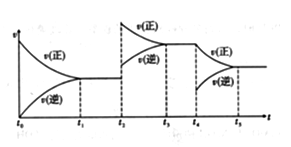
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时的值最大
(4)氨和联氨(N2H4)是氨的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2 :1,写出该反应的化学方程式:_________。标况下,每消耗1.12L氨气,转移_________mol电子。
(5)已知:N2(g)+O2(g)═2NO(g) ΔH=+180.5Kj/mol; N2(g)+3H2(g)  2NH3(g)
2NH3(g)
ΔH=-92.4kJ/mol; 2H2(g) +O2 (g) ═2H2O(g) ΔH=-483.6kJ/mol。
若有34g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为_________。
-
27.(14分)氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用。试回答下列问题:
(1)N2和H2为原料合成氨气的反应为:N2(g)+3H2(g) 2NH3(g) △H<0,下列措施可以提高H2的转化率是(填选项序号) 。
2NH3(g) △H<0,下列措施可以提高H2的转化率是(填选项序号) 。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的NH3 d.升高温度
(2)在恒温条件下,将N2与H2按一定比例混合的气体充入一个2L固定容积的密闭容器中,10分钟后反应达平衡时,n(N2)=1.0mol,n(H2)=1.0mol,n(NH3)=0.4mol,则反应速率v(N2)= mol/(L·min)。
(3)在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g) △H>0
2NO2(g) △H>0
该反应的反应速率(v)随时间(t)变化的关系如下图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号) 。
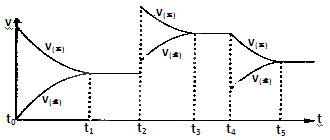
a.在t1-t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3-t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0-t5时,容器内NO2的体积分数在t3-t4时值的最大
(4)氨和联氨(N2H4)是氮的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式: 。
(5)已知:N2(g)+O2(g) = 2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol
若有17 g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为 。
(6)直接供氨式碱性燃料电池的电池反应式是4NH3 + 3O2 = 2N2 + 6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是 .从理论上分析,该电池工作过程中 (填“需要”或“不需要”)补充碱(KOH).
-
制取硝酸铵的流程图如下:
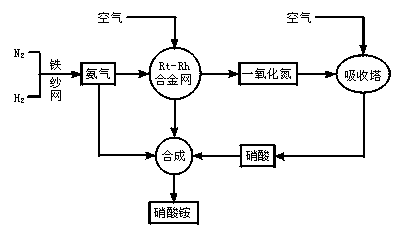
请回答下列问题:
(1)合成氨的原料通常各来自何处?
(2)已知N2(g)+3H2(g) 2NH3(g),Q>0。请解释:
2NH3(g),Q>0。请解释:
①什么是可逆反应?
②为有效提高氨的产率,实际生产中宜采取哪些措施?
(3)写出氨催化氧化的化学方程式。铂—铑合金网有何作用?为什么铂铑合金网未预热也会发热?
(4)举出硝酸铵的两种主要用途。解释为什么该用途对现代社会非常重要?
(5)在一定温度和压强的密闭容器中,将平均式量为8.5的H2和N2混合,当该反应达到平衡时,测出平衡混合气的平均式量为10,此时N2的转化率为______________,平衡混合气体中NH3的体积分数为____________________________________。
(6)请你为硝酸厂的选址提出合理化建议。
-
合成氨工业对国民经济和社会发展具有重要的意义,其原理是:
N2(g)+3H2(g)⇌2NH3(g) △H=-92.4KJ/mol,
(1)已知合成氨反应在某温度下2L的密闭容器中进行,测得数据如下表:
| 不同时间各物质的物质的量/mol |
| 0min | 1min | 2min | 3min | 4min |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
| | | | | |
根据表中数据计算:
①0 min~1 min内N2的平均反应速率为_____________
②该条件下反应的平衡常数k=________(保留两位小数)
③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,化学平衡向___________(填“正向”、“逆向”或“不移动”),该反应的平衡常数k___________(填“变大”“减小”或“不变”)
④能表明该反应达到平衡状态的是__________(选填序号)
A.N2的转化率等于NH3的产率
B.混合气体的平均相对分子质量不变
C.v(N2)与v(H2)的比值不变
D.混合气体的密度不变
(2)室温下向10mL0.3mol/LNaOH溶液中加入0.3mol/L的一元酸HA溶液pH的变化曲线如图,下列说法正确的是__________。
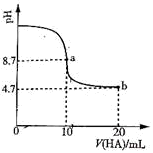
A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.b点所示溶液中c(A-)>c(HA)
D.pH=7时,c(Na+)= c(A-)+ c(HA)
E.b点所示溶液中c(HA)+c(A-)=0.2mol/L
-
合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应:N2(g)+3H2(g)  2NH3(g) △H<0。400℃、30MPa下n(NH3)和n(H2)随时间变化的关系如图,下列叙述错误的是( )
2NH3(g) △H<0。400℃、30MPa下n(NH3)和n(H2)随时间变化的关系如图,下列叙述错误的是( )

A.点a的正反应速率比b点的大
B.点c处反应还未达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,500℃下反应至t1时刻,n(H2)比右图中d点的值大
-
研究氮及其化合物具有重要意义。请回答下列问题:
(1)脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g) +NO(g) +NO2(g) 2N2(g) +3H2O(g) △H<0,反应的氧化剂是________________。
2N2(g) +3H2O(g) △H<0,反应的氧化剂是________________。
(2)巳知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) △H<0,现将一定量的混合气体通入一恒温密闭容器中反应,浓度随时间变化关系如图所示。则图中两条曲线X和Y,表示N2O4浓度变化的是____,b、c、d三点的化学反应速率大小关系是______;25min时,曲线发生图中变化,可采取的措施是_________。
N2O4(g) △H<0,现将一定量的混合气体通入一恒温密闭容器中反应,浓度随时间变化关系如图所示。则图中两条曲线X和Y,表示N2O4浓度变化的是____,b、c、d三点的化学反应速率大小关系是______;25min时,曲线发生图中变化,可采取的措施是_________。

(3)25℃时,将NH3溶于水得100 mL0.1 mol • L-1的氨水,测得pH=11,则该条件下,NH3 • H2O的电离平衡常数Kb=_______。
(4)已知:N2(g)+O2(g)=2NO(g) △H=+180kJ/mol;
2NO(g)+O2(g)=2NO2(g) △H=-112kJ/mol;
2C(s)+O2(g)=2CO(g) △H=-221kJ/mol;
C(s)+O2(g)=CO2 (g) △H=-393.5kJ/mol。
则反应4CO(g)+2NO2(g)=4CO2 (g)+ N2(g) △H=________。
(5)用电化学法可获得N2O5。如图装置中,阳极的电极反应式为:N2O4+2HNO3-2e-=2N2O5+2H+,则该电解反应的化学方程式为________________。
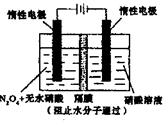
-
合成氨对农业生产及国防建设均具有重要意义。
N2(g)+3H2(g)  2NH3(g) △H =" -92" kJ·mol-1
2NH3(g) △H =" -92" kJ·mol-1
(1)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______(填序号)。
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(2)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题:

① 表示N2的浓度变化的曲线是________(选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2的浓度变化表示的化学反应平均速率是________。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = ________(计算结果可用分数表示)。
若升高温度,该反应的平衡常数值将_______(填“增大”、“减小”或“不变”)。
-
合成氨对农业生产及国防建设均具有重要意义。
N2(g)+3H2(g)  2NH3(g) △H = -92 kJ·mol-1
2NH3(g) △H = -92 kJ·mol-1
(1)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(2)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题:
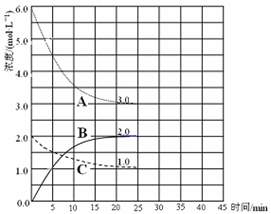
① 表示N2 的浓度变化的曲线是________(选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2 的浓度变化表示的化学反应平均速率是________。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = ________(计算结果可用分数表示)。若升高温度,该反应的平衡常数值将_______________(填“增大”、“减小”或“不变”)。
(3)在第25 min 末,保持其它条件不变,若升高反应温度并设法保持该温度不变,在第35 min末再次达到平衡。平衡移动过程中H2 浓度变化了1.5 mol·L-1,请你在图中画出第25 min ~ 40 min NH3浓度变化曲线。
(4)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol 。
①达平衡时,H2的转化率α1 = ____________________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1 + α2 =1时,则起始时n (NH3)= ________________mol。
2NH3(g) △H<0。向恒温恒容密闭的反应容器中投料1 mol N2、3 mol H2,在不同温度下分别达平衡时,混合气中NH3的物质的量分数随压强变化的曲线如图所示:










