-
实验小组研究SO2与Na2O2的反应。
(1)实验前分析物质的化学性质,提出假设:
假设1:SO2和CO2都是酸性氧化物。类比CO2与Na2O2的反应可知,SO2与Na2O2反应生成Na2SO3和O2;
假设2:SO2具有______性,SO2与Na2O2反应生成Na2SO4。
(2)用下图所示装置进行SO2与Na2O2反应的实验。实验过程中,观察到C中淡黄色粉末逐渐变为白色,用带火星的木条靠近D中导气管口,木条复燃。
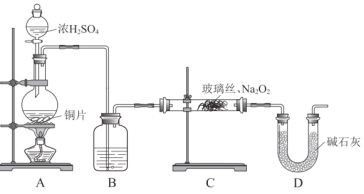
①A中反应产生SO2的化学方程式是______。
②B中的试剂为______,其主要作用是干燥SO2。
③能证明假设1成立的实验现象是______。
(3)为检验C中是否有Na2SO4生成,设计如下方案:
取少量C中反应后的白色固体溶解于水,加入BaCl2溶液,产生白色沉淀,再加入足量的稀HNO3,仍有白色沉淀不溶解,证明有Na2SO4生成。
该方案是否合理?______(填“合理”或“不合理”)。请简要说明理由:______。
(4)进一步实验证明C中反应后的固体中既有Na2SO3又有Na2SO4。从氧化还原反应的角度分析,+4价硫元素能被氧化为+6价。在上述实验条件下,+4价硫元素未完全转化为+6价,可见化学反应实际进行的情况与反应的______(只写一条)有关。
-
某校化学课外研究小组为研究浓硫酸与金属M 反应的气体生成物,进行了下列实验活动:
【提出假设】
假设1:气体生成物只有SO2;
假设2:气体生成物只有H2;
假设3:_______________________________________。
【实验验证】实验装置及实验中使用的试剂如图:

在装入药品前,甲同学检查装置A 的气密性,方法是____________________________________________________________________________________。
(2)乙同学通过所学知识排除了上面提出的一个假设,他排除的是假设_____,理由是______________________________________________________。
(3)如果假设3 正确,填写下表中的实验现象:
| 装置 | B | F | G |
| 实验现象 | _____ | _____ | _____ |
装置C 的作用是___________________________,写出装置C中发生反应的离子方程式__________________________________________________。
(5)装置D 的作用是________________________________________。
-
某研究性学习小组学生根据氧化还原反应规律,探究NO2、NO与Na2O2反应的情况,提出假设并进行相关实验。
Ⅰ.从理论上分析Na2O2和NO2都既有氧化性又有还原性,于是提出如下假设:
假设1:Na2O2氧化NO2;
假设2:NO2氧化Na2O2。
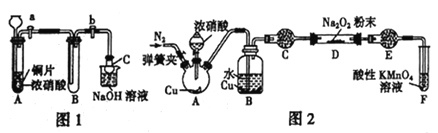
(1)甲同学设计如图1装置进行实验:
①试管A中反应的离子方程式是_________________________________________。
②待试管B中充满红棕色气体,关闭旋塞a和b;取下试管B;向其中加入适量Na2O2粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
③仪器C兼有防倒吸的作用,仪器C的名称为___________________。
结论:甲同学认为假设2正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是________________________。乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;带火星的木条未复燃,得出结论:假设1正确,则NO2和Na2O2反应的化学方程式是_______________________。
Ⅱ.该研究性学习小组同学还认为NO易与O2发生反应,应该更易被Na2O2氧化。查阅资料:2NO+Na2O2=2NaNO2;2NaNO2+2HCl=2NaCl+NO2↑+NO↑+H2O;酸性条件下,NO能与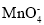 反应生成
反应生成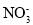 和Mn2+。
和Mn2+。
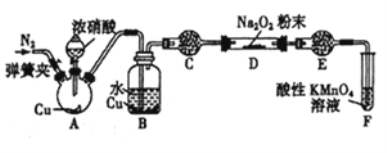
(3)丙同学用图2所示装置(部分夹持装置略)探究NO与Na2O2的反应。
①在反应前,打开弹簧夹,通入一段时间N2,目的是_________________。
②B中不能观察到的现象是____________(填字母编号)。
a.铜片逐渐溶解,溶液变为蓝色b.有红棕色气泡产生c.有无色气泡产生
③C、E中所盛装的试剂不能是________(填字母编号)。
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④F中发生反应的氧化剂与还原剂的物质的量之比为_____________。
⑤充分反应后,检验D装置中产物的方法是:______________,则产物是NaNO2。
-
某研究性学习小组学生用图中所示装置(部分夹持装置略)探究NO与Na2O2反应的情况,提出假设并进行相关实验。
该研究性学习小组同学认为NO 易与O2发生反应,应该更易被Na2O2氧化。查阅资料:2NO+Na2O2=2NaNO2;2NaNO2+2HCl=2NaCl+NO2↑+NO↑+H2O; 酸性条件下,NO 能与MnO4-反应生成NO3-和Mn2+。
(1)在反应前,打开弹簧夹,通入一段时间N2,目的是__________________________。
(2)A 中反应的氧化剂与还原剂的物质的量之比为______________。
(3)B 中观察到的主要现象是____________(填字母编号)。
a.铜片逐渐溶解,溶液变为蓝色 b.有红棕色气泡产生 C.有无色气泡产生
(4)C、E 中所盛装的试剂不能是________(填字母编号)。
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
(5)F 中反应的离子方程式是_________________________________________。
(6)充分反应后,检验D装置中产物的方法是: _____________________________ ,则产物是NaNO2。
-
某课外小组设计了下图所示的实验装置(图中固定装置已略去),进行SO2性质的研究。

(1)从物质分类的角度,SO2属于________(填“酸性”或“碱性”)氧化物。写出硫酸型酸雨形成的反应方程式: _______ ,_____ 。
(2)图中D装置可用来验证SO2具有该性质,其中所加入的试剂是 _____。
(3)当向该装置通入SO2时,A中紫色石蕊溶液变红,用化学用语解释其原因是 ______ 。
(4)从元素化合价的角度分析,SO2的性质。
①当向该装置通入SO2一段时间后,可观察C中溶液褪色,MnO4-转化为Mn2+,说明SO2具
有______性,反应的离子方程式为 _________。
②如验证SO2还具有另一方面的性质,可选择的药品是__________。
A.过氧化氢 B.浓硫酸 C.氯水 D.硫化钠溶液
-
某些资料认为NO、NO2不能与Na2O2反应。南开中学化学学习小组提出质疑,他们分析过氧化钠和二氧化氮都有氧化性,根据化合价升降原则提出假设:
假设I:过氧化钠氧化二氧化氮,生成NaNO3;
假设II:二氧化氮氧化过氧化钠,生成O2。
(1)小组甲同学设计实验如下:
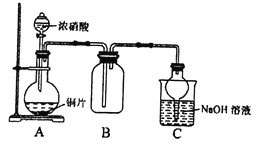
①试管A中反应的化学方程式是__________。
②待试管B中收集满气体,向试管B中加入适量Na2O2,塞紧塞子,振荡试管,观察到红棕色气体迅速消失;再将带火星木条迅速伸进试管内,木条复燃。甲同学认为假设I正确;乙同学认为该装置不能达到实验目的,为达到实验目的,应在A、B之间增加一个浓硫酸洗气装置,该装置的作用是_______。
③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;带火星木条未复燃。得出结论:假设I正确。NO2和Na2O2反应的方程式是________。
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化。
查阅资料:①2NO+Na2O2=2NaNO2
②亚硝酸盐在酸性条件下不稳定:2H++3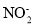 =
=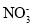 +2NO↑+H2O。
+2NO↑+H2O。
丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。
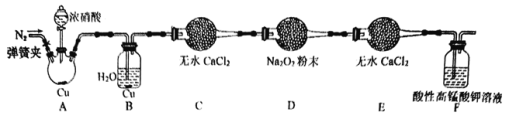
①在反应前,打开弹簧夹,通入一段时间N2,目的是_________。
②充分反应后,取D装置中产物少许,加入稀盐酸,若观察到________现象,则产物是亚硝酸钠。
③F装置的作用是________。该装置中发生反应的离子方程式为_________。
-
燃煤产生的SO2会污染空气。某实验小组用下图装置(夹持仪器略、气密性好)探究SO2的性质,并研究治理措施。
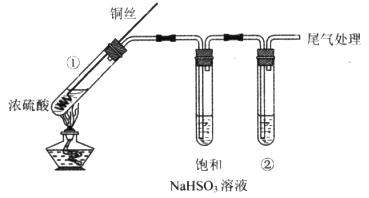
(1)装置①中反应的化学方程式是_______________。
(2)从物质类别的角度分析,SO2和CO2具有相似的化学性质,欲验证该性质,②中可选用的试剂及预期的实验现象是_________________。
(3)当②中为氢硫酸(溶质为H2S)时,观察到②中出现黄色沉淀,说明SO2具有的化学性质是_______________。
(4)当②中为碘水时,观察到②中溶液由黄色变为无色,由此推测所得无色溶液中的离子主要是H+、I-和_________;通过进一步实验证实了该过程中SO2已被氧化,实验操作及现象是______________。
(5)结合SO2的性质,请你针对煤的使用及其产生的环境污染提出一条解决或缓解的建议:_______________。
-
某些资料表明:NO、NO2不能与Na2O2反应。某小组学生提出质疑,他们从理论上分析Na2O2和NO2都有氧化性,根据化合价升降原则提出如下假设:
假设Ⅰ. Na2O2氧化NO2; 假设Ⅱ. NO2氧化Na2O2。
请回答下列问题:
(1)甲同学设计如图1所示实验装置:
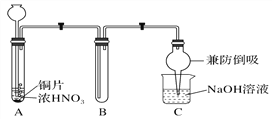
图1
①试管A中反应的离子方程式是___________________________________________________。
②待试管B中收集满气体,向试管B中加入适量Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。甲同学据此认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的,为达到实验目的,应在A、B之间增加一个装置,该装置的作用是__________________________________________________________________。
③乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失,带火星的木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的化学方程式是_____________________。
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化,查阅资料知:
ⅰ) 2NO+Na2O2===2NaNO2;
ⅱ) 6NaNO2+3H2SO4===3Na2SO4+2HNO3+4NO↑+2H2O;
ⅲ)酸性条件下,NO或NO 都能与MnO
都能与MnO 反应生成NO
反应生成NO 和Mn2+。
和Mn2+。
丙同学用图2所示装置(部分夹持装置略)探究NO与Na2O2的反应:
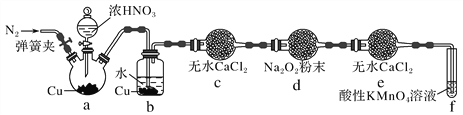
图2
①b装置中观察到的主要现象是__________________________________________________,f装置的作用是_________________________________________________________________。
②在反应前,先打开弹簧夹,通入一段时间N2,其目的是____________________________
③充分反应后,检验d装置中发生反应的实验是___________________________。
-
某化学兴趣小组学习了CO2和Na2O2反应后,想探究SO2和Na2O2反应的情况.
①甲学生判断SO2和Na2O2反应与CO2和Na2O2反应相似,有氧气生成,则该反应化学方程式______.
②乙学生判断SO2和Na2O2反应能生成硫酸钠,则该反应的化学方程式为______.
③该小组同学无法断定SO2和Na2O2反应中是否有氧气生成,拟使用下列装置进行实验.
装置D的作用是______.
④为确认反应产物,请完成下列实验表格
| 操 作 | 现象及结论 |
| ①确认是否有氧气生成: | |
| ②确认是否有硫酸钠生成: | |
-
过氧化钠(Na2O2)是中学常见物质。已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成。有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,能被过氧化钠氧化生成硫酸钠,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。
实验一:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
(1)提出假设:假设1:反应后固体中只有________,证明SO2未被氧化;
假设2:反应后固体中只有________,证明SO2完全被氧化;
假设3:__________________________证明______________________。
实验探究:实验二:通过测量气体的体积判断发生的化学反应,实验装置如下:
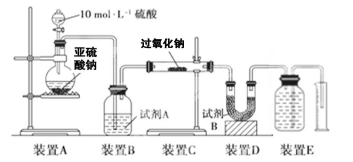
(2)试剂A可以选用________,试剂B的作用是________。
(3)实验测得装置C中过氧化钠质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据判断, SO2未被氧化时、完全被氧化的V-m1关系式。
未被氧化:____________,完全被氧化:____________。
(4)若SO2完全被氧化,写出反应的化学方程式: __________________________。



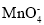 反应生成
反应生成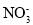 和Mn2+。
和Mn2+。


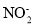 =
=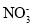 +2NO↑+H2O。
+2NO↑+H2O。




