-
某学习小组研究溶液中Fe2+的稳定性,进行如下实验,记录结果。
【实验Ⅰ】

| 物质 | 0 min | 1min | 1h | 5h |
| FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
| ((NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
(1)上述(NH4)2Fe(SO4)2溶液pH小于FeSO4的原因是_____________(用离子方程式表示)。溶液的稳定性:FeSO4_______(NH4)2Fe(SO4)2(填“>”或“<”)。
(2)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性。进行【实验Ⅱ】,否定了该观点,请补全该实验。
| 操作 | 现象 |
| 取__________,滴加_______,观察。 | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。 |
(3)乙同学提出【实验Ⅰ】中两溶液的稳定性差异是溶液酸性不同导致,进行【实验III】,分别配制0.8 mol L—pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
L—pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
资料显示:亚铁盐溶液中存在反应4Fe2++O2+10H2O  4Fe(OH)3+8H+
4Fe(OH)3+8H+
由【实验III】,乙同学可得出实验的结论是___________________________,原因是___________________________________________________________。
(4)进一步研究在水溶液中Fe2+的氧化机理。测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如图(实验过程中溶液温度几乎无变化)。反应初期,氧化速率都逐渐增大的原因可能是__________________________________________。
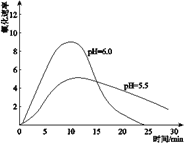
(5)综合以上实验,增强Fe2+稳定性的措施有__________________________。
(6)向溶液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、用蒸馏水洗涤和_____________________,应选用___________式滴定管。
②若滴定xmL滤液中的Fe2+,消耗amol·L—1K2Cr2O7标准溶液bmL,则滤液中c(Fe2+)=______mol·L-1。
-
某学习小组研究溶液中Fe2+的稳定性,进行如下实验,观察,记录结果。

实验Ⅰ
| 物质 | 0 min | 1min | 1h | 5h |
| FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
| (NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
(1)上述(NH4)2Fe(SO4)2溶液pH小于FeSO4的原因是________________(用化学用语表示)。溶液的稳定性:FeSO4_______(NH4)2Fe(SO4)2(填“>”或“<”) 。
(2)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性。进行实验Ⅱ,否定了该观点,补全该实验。
| 操作 | 现象 |
| 取________________________, 滴加__________________,观察。 | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。 |
(3)乙同学提出实验Ⅰ中两溶液的稳定性差异是溶液酸性不同导致,进行实验Ⅲ:分别配制0.80 mol·L-1 pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
资料显示:亚铁盐溶液中存在反应4Fe2++O2+10H2O  4Fe(OH)3+8H+
4Fe(OH)3+8H+
由实验III,乙同学可得出实验的结论是____________,原因是______________________。

(4)进一步研究在水溶液中Fe2+的氧化机理。测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如图(实验过程中溶液温度几乎无变化)。反应初期,氧化速率都逐渐增大的原因可能是______________。
(5)综合以上实验,增强Fe2+稳定性的措施有_________________。
(6)向溶液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、_________ 和_______________。
②若滴定xmL滤液中的Fe2+,消耗amol·L—1K2Cr2O7标准溶液bmL,则滤液中c(Fe2+)= ___________mol·L-1
-
某学习小组研究溶液中Fe2+的稳定性;进行如下实验,观察,记录结果。
实验I

(1)上述(NH4)2Fe(SO4)2溶液pH小于FeSO4的原因是_____________(用化学用语表示)。溶液的稳定性:FeSO4_______(NH4)2Fe(SO4)2(填“>”或“<”)。
(2)甲同学提出实验I中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+有还原性,进行实验Ⅱ,否定了该观点,补全该实验。

(3)乙同学提出实验I中两溶液的稳定性差异是溶液酸性不同导致,进行实验Ⅲ;分别配制0.80mol•L-1pH为1、2、3、4的FeSO4溶液,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
资料显示:亚铁盐溶液中存在反应 4Fe2++O2+10H2O 4Fe(OH)3+8H+ 由实验Ⅲ,乙同学可得出的结论是_________,原因是_________。
4Fe(OH)3+8H+ 由实验Ⅲ,乙同学可得出的结论是_________,原因是_________。
(4)进一步研究在水溶液中Fe2+的氧化机理,测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如图(实验过程中溶液温度几乎无变化)。反应初期,氧化速率逐渐增大的原因可能是_________。
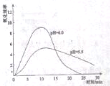
(5)综合以上实验,增强Fe2+稳定性的措施有_________。
-
为研究铁盐与亚硫酸盐之间的反应,某研究小组利用孔穴板进行了实验探究:
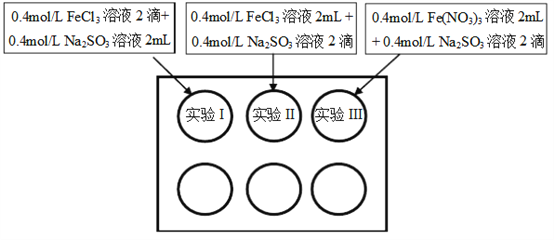
小组记录的实验现象如下表所示:
| 开始时 | 5min后 | 3天后 |
| 实验I | 溶液立即变为红褐色,比II、III中略浅 | 与开始混合时一致 | 溶液呈黄色,底部出现红褐色沉淀 |
| 实验II | 溶液立即变为红褐色 | 红褐色明显变浅 | 溶液呈黄绿色 |
| 实验III | 溶液立即变为红褐色 | 红褐色变浅,比II中深 | 溶液呈黄色 |
(1)测得实验所用0.4mol/L FeCl3溶液及Fe(NO3)3溶液pH均约为1.0。两溶液均呈酸性的原因是__________(用离子方程式表示)。
(2)开始混合时,实验I中红褐色比II、III中略浅的原因是___________。
(3)为了探究5min后实验II、III中溶液红褐色变浅的原因,小组同学设计了实验IV:分别取少量5min后实验I、II、III中溶液,加入2滴铁氰化钾溶液,发现实验II、III中出现蓝色沉淀,实验I中无明显变化。根据实验IV的现象,结合化学用语解释红褐色变浅的原因是___________。
(4)针对5min后实验III中溶液颜色比实验II中深,小组同学认为可能存在三种因素:
①Cl- 可以加快Fe3+与SO32-的氧化还原反应;
②___________;
③NO3- 在酸性环境下代替Fe3+氧化了SO32-,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
通过实验V和实验VI进行因素探究:
| 实验操作(已知Na+对实验无影响) | 5min后的现象 |
| 实验V | 在2mL pH=1.0的0.4mol/L Fe(NO3)3溶液中溶解约___________固体,再加入2滴0.4mol/L Na2SO3溶液 | 溶液的红褐色介于II、III之间 |
| 实验VI | 在2mL pH=1.0的稀硝酸中溶解约0.19g NaNO3固体,再加入2滴0.4mol/L Na2SO3溶液。向其中滴入少量BaCl2溶液 | _____________ |
实验结论:因素①和因素②均成立,因素③不明显。请将上述方案填写完整。
(5)通过上述实验,以下结果或推论合理的是___________(填字母)。
a.Fe3+与SO32-同时发生水解反应和氧化还原反应,且水解反应的速率快,等待足够长时间后,将以氧化还原反应为主
b.浓度为1.2 mol/L的稀硝酸在5min内不能将Fe2+氧化
c.向pH大于1的稀硝酸中加入少量Ba(NO3)2,使其完全溶解,可用来检验实验I的上层清液中是否存在SO42-
-
为研究铁盐与亚硫酸盐之间的反应,某研究小组利用孔穴板进行了实验探究:

小组记录的实验现象如下表所示:
| 开始时 | 5min后 | 3天后 |
| 实验I | 溶液立即变为红褐色,比II、III中略浅 | 与开始混合时一致 | 溶液呈黄色,底部出现红褐色沉淀 |
| 实验II | 溶液立即变为红褐色 | 红褐色明显变浅 | 溶液呈黄绿色 |
| 实验III | 溶液立即变为红褐色 | 红褐色变浅,比II中深 | 溶液呈黄色 |
(1)测得实验所用0.4mol/L FeCl3溶液及Fe(NO3)3溶液pH均约为1.0。两溶液均呈酸性的原因是__________(用离子方程式表示)。
(2)开始混合时,实验I中红褐色比II、III中略浅的原因是___________。
(3)为了探究5min后实验II、III中溶液红褐色变浅的原因,小组同学设计了实验IV:分别取少量5min后实验I、II、III中溶液,加入2滴铁氰化钾溶液,发现实验II、III中出现蓝色沉淀,实验I中无明显变化。根据实验IV的现象,结合化学用语解释红褐色变浅的原因是___________。
(4)针对5min后实验III中溶液颜色比实验II中深,小组同学认为可能存在三种因素:
①Cl- 可以加快Fe3+与SO32-的氧化还原反应;
②___________;
③NO3- 在酸性环境下代替Fe3+氧化了SO32-,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
通过实验V和实验VI进行因素探究:
| 实验操作(已知Na+对实验无影响) | 5min后的现象 |
| 实验V | 在2mL pH=1.0的0.4mol/L Fe(NO3)3溶液中溶解约___________固体,再加入2滴0.4mol/L Na2SO3溶液 | 溶液的红褐色介于II、III之间 |
| 实验VI | 在2mL pH=1.0的稀硝酸中溶解约0.19g NaNO3固体,再加入2滴0.4mol/L Na2SO3溶液。向其中滴入少量BaCl2溶液 | _____________ |
实验结论:因素①和因素②均成立,因素③不明显。请将上述方案填写完整。
(5)通过上述实验,以下结果或推论合理的是___________(填字母)。
a.Fe3+与SO32-同时发生水解反应和氧化还原反应,且水解反应的速率快,等待足够长时间后,将以氧化还原反应为主
b.浓度为1.2 mol/L的稀硝酸在5min内不能将Fe2+氧化
c.向pH大于1的稀硝酸中加入少量Ba(NO3)2,使其完全溶解,可用来检验实验I的上层清液中是否存在SO42-
-
某学习小组同学进行实验探究FeCl3溶液和Na2S溶液的反应原理。
Ⅰ.学习小组的同学通过查阅以下资料和所学知识,预测产物。
资料:Fe2S3和FeS均为黑色、不溶于水、能溶于酸的固体,Fe2S3固体常温下易转变为黄绿色;H2S为有臭鸡蛋气味的气体。0.1mol/LNa2S溶液的pH约为12.9。
Ksp近似数据:Fe(OH)3为10-39,Fe2S3为10-88,FeS为10-19。
(1)同学甲计算出0.1mol/L的FeCl3溶液的pH约为__,依据酸碱理论的相关知识预测FeCl3与Na2S可能发生水解反应,则该反应的离子方程式为___。
(2)同学乙依据难溶电解质的溶解平衡理论的相关知识预测反应主要产生Fe2S3而不是Fe(OH)3的原因为__。
(3)同学丙依据氧化还原反应理论的相关知识预测FeCl3溶液与Na2S溶液反应可生成FeS和S的混合物,则反应的离子方程式为__。
Ⅱ.学习小组进行实验,探究反应生成沉淀物的成分。
实验一:
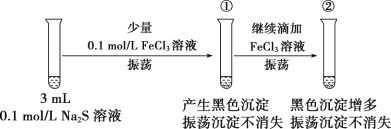
(4)某同学设计实验证明试管①中黑色物质含有Fe2S3,该同学的实验操作为_____。
(5)另一同学将试管②中黑色沉淀过滤洗涤后溶解于稀硫酸获得淡黄色悬浊液并闻到臭鸡蛋气味,判断沉淀为FeS和S的混合物,但有同学认为此判断不合理,请说明理由:__。
实验二:
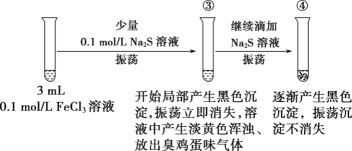
(6)若试管③中沉淀溶解现象是因为溶液酸性较强将产生的少量黑色沉淀溶解,用离子方程式表示溶液酸性较强的原因:__。
(7)FeCl3溶液和Na2S溶液间可发生复分解反应也可发生氧化还原反应,且反应的产物、实验的现象与__等有关(写出一条即可)。
-
某研究性学习小组在CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,若温度不均时会生成Fe3O4,也能被磁铁吸引。为了探究X的组成,他们进行了如下实验。
I、定性检验
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色,有少量气泡产生 |
| ② | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
由上述实验现象推断,黑色粉末X的成分是________。
II、定量测定
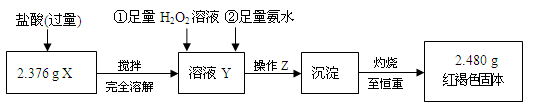
⑴ 操作Z的名称是,如图19的仪器中,在灼烧沉淀时必须用到的是________(填字母)。
⑵ 写出溶液Y中滴加H2O2溶液时发生反应的离子方程式:
________。
⑶ 将沉淀物加热,并置于干燥器中冷却至室温,用托盘天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1 - b2 = 0.3 g,则接下来还应进行的操作是
________。
⑷ 有同学认为:上述流程若不加入H2O2,其它步骤不变,只要在空气中充分放置仍可达到目的。他的理由是(用化学方程式表示):
________。
⑸ 通过以上数据,得出2.376 g黑色粉末中各成分的物质的量为。
-
某研究小组模拟工业上以黄铁矿为原料制备硫酸的第一步反应如下:4FeS2+11O2 2Fe2O3+8SO2进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。
2Fe2O3+8SO2进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。
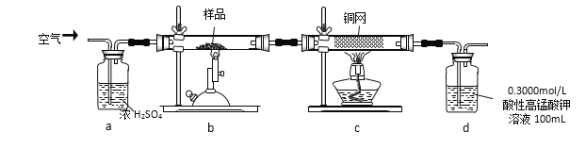
实验步骤:称取研细的样品4.000g放入上图b装置中,然后在空气中进行煅烧。为测定未反应高锰酸钾的量(假设其溶液体积保持不变),实验完成后取出d中溶液10mL置于锥形瓶里,用0.1000mol/L草酸(H2C2O4)标准溶液进行滴定。(已知:5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4 )请回答下列问题:
(1)称量样品质量能否用托盘天平_______(填“能”或“不能”),取出d中溶液10mL需要用______准确量取(填序号)
A.容量瓶 B.量筒 C.碱式滴定管 D.酸式滴定管
(2)上述反应结束后,仍需通一段时间的空气,其目的是__________
(3)已知草酸与高锰酸钾酸性溶液作用有CO2和Mn2+等物质生成,则滴定时发生反应的离子方程式为_______________﹔判断滴定到达终点的方法是___________。
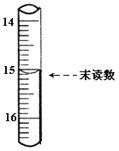
(4)已知滴定管初读数为0.10mL,末读数如图所示,消耗草酸溶液的体积为___________mL。
下列操作会导致该样品中FeS2的纯度测定结果偏高的是_________(填序号)
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失
(5)该样品中FeS2的纯度为__________________
(6)若用下图装置替代上述实验装置d,同样可以达到实验目的的是_______(填编号)。
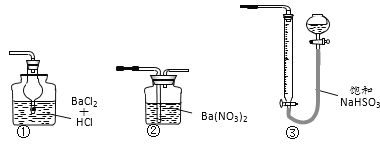
-
(18分)某研究性学习小组在CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,若温度不均时会生成Fe3O4,也能被磁铁吸引。为了探究X的组成,他们进行了如下实验。
I、定性检验
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色,有少量气泡产生 |
| ② | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
由上述实验现象推断,黑色粉末X的成分是________。
II定量测定
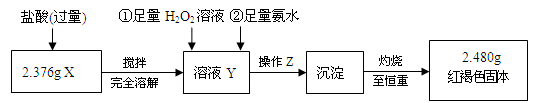
⑴操作Z的名称是________。
下列仪器中,在灼烧沉淀时必须用到的是________(填字母)。



A B C D E F
⑵写出溶液Y中滴加H2O2溶液时发生反应的离子方程式________。
⑶将沉淀物加热,并置于干燥器中冷却至室温,用托盘天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1 —b2 = 0.3g,则接下来还应进行的操作是
。
⑷有同学认为:上述流程若不加入H2O2,其它步骤不变,只要在空气中充分放置仍可达到目的。他的理由是________。(用化学方程式表示)
⑸通过以上数据,得出2.376g黑色粉末中各成分的物质的量为________。
-
某研究性学习小组在用CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引.为探究X的成分,他们进行了如下实验.
I.定性检验
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有少量气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液出现血红色 |
| ③ | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
(1)实验②的目的是________.
(2)由上述实验现象推断,黑色粉末X的成分是________(填化学式).
II.定量测定
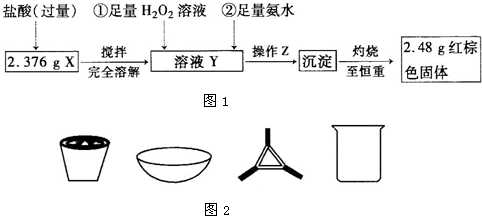
(1)操作Z是________.图2仪器中,在灼烧沉淀时必须用到的是________(填名称).
(2)写出溶液Y中滴加H2O2溶液时发生反应的离子方程式________.
(3)通过以上数据,得出2.376g黑色粉末X中各成分的物质的量为________.

L—pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
4Fe(OH)3+8H+



















