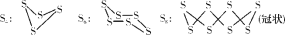-
一定条件下,CO2与NH3反应可制得重要的化工产品三聚氰胺:3NH3 + 3CO2
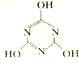 +3H2O。
+3H2O。
(1)基态N原子的价层电子排布图为____________,三聚氰胺的几种组成元素中,第一电离能最大的元素是____________(填元素符号),电负性由大到小的顺序为____________(用元素符号表示)。
(2)三聚氰胺中氮原子、碳原子的杂化轨道类型分别为____________,NH3、CO2、H2O三种分子中化学键的键角由大到小的顺序为____________。
(3)上述四种分子中所有原子一定共平面的是____________,反应过程中存在多种类型化学键的断裂与形成,但这些化学键中不包括____________(填选项字母)。
a.α键 b.π键 c.非极性共价键 d.极性共价键
(4)三聚氰胺的熔点为250 ℃,则其晶体类型是____________,又知硝基苯的熔点为5.7 ℃,异致这两种物质熔点差异的原因是____________。
(5)随者科学技术的发展,科学家们已合成了由碳、氧两种元素形成的原子晶体.其晶胞结构如右图所示:
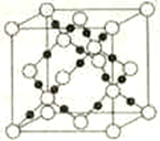
①该晶体的化学式为____________,晶体中氧原子的配位数是____________。
②若晶胞参数为a pm,设NA表示阿伏加德罗常数的值,则该晶胞的密度是____________ g • cm-3。
-
一定条件下,CO2与NH3反应可制得重要的化工产品三聚氰胺:3NH3 + 3CO2
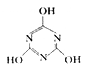 +3H2O。
+3H2O。
(1)基态N原子的价层电子排布图为____________,三聚氰胺的几种组成元素中,第一电离能最大的元素是____________(填元素符号),电负性由大到小的顺序为____________(用元素符号表示)。
(2)三聚氰胺中氮原子、碳原子的杂化轨道类型分别为____________,NH3、CO2、H2O三种分子中化学键的键角由大到小的顺序为____________。
(3)上述四种分子中所有原子一定共平面的是____________,反应过程中存在多种类型化学键的断裂与形成,但这些化学键中不包括____________(填选项字母)。
a.α键 b.π键 c.非极性共价键 d.极性共价键
(4)三聚氰胺的熔点为250 ℃,则其晶体类型是____________,又知硝基苯的熔点为5.7 ℃,异致这两种物质熔点差异的原因是____________。
(5)随者科学技术的发展,科学家们已合成了由碳、氧两种元素形成的原子晶体.其晶胞结构如图所示:
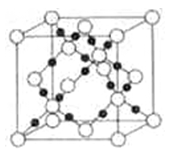
①该晶体的化学式为____________,晶体中氧原子的配位数是____________。
②若晶胞参数为a pm,设NA表示阿伏加德罗常数的值,则该晶胞的密度是____________ g • cm-3。
-
CO2的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰胺的反应:NH3+CO2→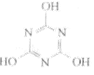 +H2O,下列有关三聚氰胺的说法正确的是
+H2O,下列有关三聚氰胺的说法正确的是
A.分子式为C3H6N3O3
B.属于共价化合物
C.分子中既含极性键,又含非极性键
D.生成该物质的上述反应为中和反应
-
CO2的的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰胺的反应:NH3+CO2→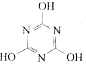 +H2O
+H2O
下列有关三聚氰胺的说法正确的是
A.分子式为C3H6N3O3 B.分子中既含极性键,又含非极性键
C.属于共价化合物 D.生成该物质的上述反应为中和反应
-
在一定条件下用NH3捕获CO2可以生成重要的有机化工产品——三聚氰酸,反应的化学方程式如下:
NH3 + CO2 →  + H2O
+ H2O
下列有关三聚氰酸的说法正确的是
A.分子式为C3H6N3O3 B.分子中既含极性键,又含非极性键
C.属于共价化合物 D.生成该物质的上述反应为中和反应
-
CO2的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰胺的反应:NH3+CO2→ +H2O
+H2O
下列说法正确的是
A.该工业生产过程中,原子利用率为100%
B.该方法运用于实际生产中,可减少环境污染
C.该化学反应属于中和反应
D.该方法可以缓解温室效应
-
将高温水蒸气通到硫氰化钾的表面,会发生反应:4KSCN + 9H2O(g) → K2CO3 + K2S + 3CO2 + 3H2S + 4NH3完成下列填空:
(1)上述反应所涉及的各元素中,离子半径最大的是_____________(填离子符号);属于第二周期元素的非金属性由强到弱的顺序为_________________。
(2)上述反应所涉及的各物质中,属于非电解质的是_________________。
(3)写出CO2的电子式____________,其熔沸点低的原因是___________________________。
(4)已知物质的量浓度均为0.10 mol/L的K2CO3和K2S溶液pH如下:
| 溶液 | K2CO3 | K2S |
| pH | 11.6 | 12.5 |
K2CO3水溶液呈碱性的原因是______________________________(用离子方程式表示)。从表中数据可知,K2CO3溶液中c(CO32-)_______K2S溶液中的c(S2—)(填“>”“<”或“=”)。
(5)K2S接触潮湿银器表面,会出现黑色斑点(Ag2S),其原理如下:____K2S + ____Ag + _____O2 + _____H2O → _____Ag2S + _____KOH
①配平上述反应________________。
②每消耗标准状况下224 mL O2,转移电子数目为_____________。
-
将甘油(C3H8O3)转化成高附加值产品是当前热点研究方向,甘油和水蒸气经催化重整可制得氢气,反应主要过程如下:
反应Ⅰ: C3H8O3(l)+3H2O(g) 3CO2(g)+7H2(g) ΔH1
3CO2(g)+7H2(g) ΔH1
反应Ⅱ: 2C3H8O3(l)+3O2(g) 6CO2(g)+8H2(g) ΔH2=a kJ·mol-1
6CO2(g)+8H2(g) ΔH2=a kJ·mol-1
反应Ⅲ: 2H2(g)+O2(g) 2H2O(g) ΔH3=b kJ·mol-1
2H2O(g) ΔH3=b kJ·mol-1
(1)ΔH1=__________。
(2)酸性条件下,甘油可在纳米TiO2Pt复合膜阳极上转化为甘油醛(C3H6O3),该电极方程式为________________________________。
(3)硝化甘油(C3H5O9N3)是治疗心绞痛的速效药,也可用作开采矿物的炸药。
①硝化甘油能治疗心绞痛的原理是在人体中释放NO,实验室中也可通过干法制备NO,方程式为3KNO2+KNO3+Cr2O3 2K2CrO4+4NO↑。若有1 mol NO生成,则被KNO3氧化的Cr2O3的物质的量为________mol。
2K2CrO4+4NO↑。若有1 mol NO生成,则被KNO3氧化的Cr2O3的物质的量为________mol。
②硝化甘油爆炸时会彻底分解为N2、O2、CO2和H2O,反应的化学方程式为__________________________________________。
(4)①反应Ⅰ制备H2时的副产物很多,主要有CH4、C2H4等,生产过程中必须采取措施抑制副产物产生,目的是__________________________________________________________。
②为了有效提高反应Ⅰ氢气的产率,研究人员还采用CaO吸附增强制氢的方法。如图1所示,请分析加入CaO提高氢气产率的原因_________________________________________。
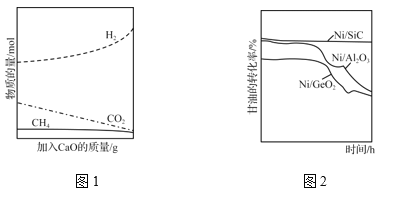
(5)高效的催化剂是这种制氢方法能大规模应用的重要因素。图2为三种不同催化剂在一段时间内与甘油转化率的关系,则Ni/SiC催化剂的优点是________________________________________________________________________。
-
研究反应过程的热量变化对于生产生活有重要意义。
Ⅰ.甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在一定条件下合成甲醇。请按要求回答下列问题:
(1)反应CO2(g)+3H2(g)  CH3OH(g)+H2O(g)在使用和未使用催化剂时,反应过程和能量的对应关系如图所示。下列说法正确的是___(填字母代号)。
CH3OH(g)+H2O(g)在使用和未使用催化剂时,反应过程和能量的对应关系如图所示。下列说法正确的是___(填字母代号)。
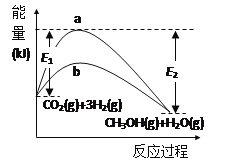
A.该可逆反应的正反应为吸热反应
B.断裂反应物中的化学键所吸收的总能量小于形成生成物中的化学键所释放的总能量
C.曲线b是使用了催化剂对应的曲线,且加入催化剂后,反应热变小
(2)CO、CO2和H2在合成过程中发生的主要反应如下:
①CO(g)+2H2(g)  CH3OH(g) ΔH1=-99 kJ·mol-1
CH3OH(g) ΔH1=-99 kJ·mol-1
②CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③CO2(g)+H2(g)  CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
则ΔH3=____。
(3)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:
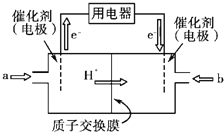
则通入a气体的电极是电池的____(填“正”或“负”)极,其电极反应式为___。
Ⅱ.已知单质硫在通常条件下以S8(斜方硫)的形式存在,而在蒸气状态下,有S2、S4、S6及S8等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结构如图所示:
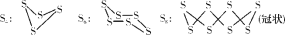
(1)在一定温度下,测得硫蒸气的平均摩尔质量为80 g·mol-1,则该蒸气中S2的体积分数不小于_____。
(2)若已知硫氧键的键能为d kJ·mol-1,氧氧键的键能为e kJ·mol-1,S(s)+O2(g)===SO2(g)ΔH=-a kJ·mol-1,则S8中硫硫键的键能为_____。
-
氢能被视为21世纪最具发展潜力的清洁能源,其开发利用是科学家们研究的重要课题。试回答下列问题:
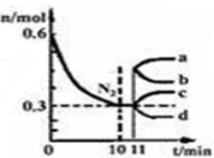
(1)氢气也可以作为化工生产的原料,如一定的条件下,合成氨反应为:N2(g)+3H2(g)  2NH3(g),该反应的平衡常数表达式为:_________________。在2L的恒容密闭容器中加入1.8mol H2和0.6mol N2,其中N2的量随时间的变化曲线如图。从llmin起,在其它条件不变的情况下,压缩容器的体积为1L,则n(N2)的变化曲线为:_____________(填“a”或“b”或“c”或“d”), 达新平衡时,c(N2)的数值为:_________。
2NH3(g),该反应的平衡常数表达式为:_________________。在2L的恒容密闭容器中加入1.8mol H2和0.6mol N2,其中N2的量随时间的变化曲线如图。从llmin起,在其它条件不变的情况下,压缩容器的体积为1L,则n(N2)的变化曲线为:_____________(填“a”或“b”或“c”或“d”), 达新平衡时,c(N2)的数值为:_________。
(2)在工业上也可以利用氢气合成液体燃料。如:工业上合成甲醇的反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H<0,该过程既可以减弱CO2的温室效应,又可以充分利用CO2。反应过程中部分数据见下表(起始:T1℃、2.0L密闭容器):
CH3OH(g)+H2O(g) △H<0,该过程既可以减弱CO2的温室效应,又可以充分利用CO2。反应过程中部分数据见下表(起始:T1℃、2.0L密闭容器):
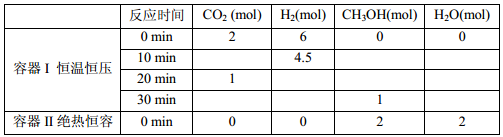
达到平衡时,反应I、II对比:平衡常数K(I)_______K(II)(填“>”“<”或“=”)。保持其他条件不变的情况下,若30 min时只向容器I中再充入1 mol CO2(g)和1mol H2O(g),则平衡______移动(填“正向”、“逆向”或“不”)。
(3) 100 kPa时,绝热密闭容器中发生反应2NO(g)+O2 (g) 2NO2(g)。一定压强下,NO的平衡转化率与温度的关系曲线如图所示。
2NO2(g)。一定压强下,NO的平衡转化率与温度的关系曲线如图所示。
: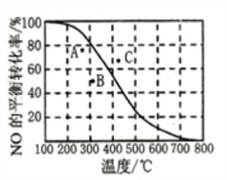
300℃时,VmL NO和0.5mLO2混合发生该反应,最终混合气体的平均摩尔质量为: _________(用含V的计算式表示)。图中A、B、C三点表示不同温度、压强下达到平衡时NO的转化率,则_____点对应的压强最大。若氧气中混有氮气,容器中还同时发生了如下反应N2(g)+O2(g)  2NO(g)△H=+180kJ/mol,则此反应对NO的转化率的影响是_________ (填“增大”、“减小”或“无法判断”),理由是______。
2NO(g)△H=+180kJ/mol,则此反应对NO的转化率的影响是_________ (填“增大”、“减小”或“无法判断”),理由是______。
 +3H2O。
+3H2O。
 +3H2O。
+3H2O。
 +H2O,下列有关三聚氰胺的说法正确的是
+H2O,下列有关三聚氰胺的说法正确的是 +H2O
+H2O