-
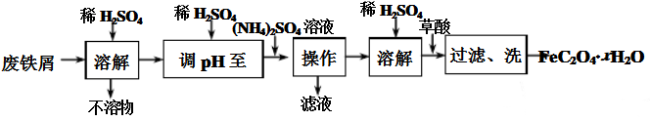
实验室以废铁屑为原料制备草酸亚铁晶体(FeC2O4·xH2O)。过程如下:

已知:①pH>4时,Fe2+易被氧气氧化;
②相关物质的溶解度曲线如图。
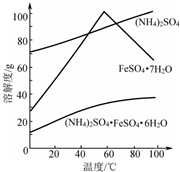
(1)①废铁屑在进行“溶解”前,需要在5%的Na2CO3 溶液中加热数分钟,并洗涤干净,Na2CO3溶液的作用是____________。
②用稀硫酸调溶液pH至1~2的目的:一是抑制Fe2+ 和NH4+的水解;二是 ________。
③操作I是为了得到(NH4)2SO4·FeSO4·6H2O,则操作I应进行蒸发浓缩、结晶、过滤。那么过滤时适宜的温度为__________。
④检验FeC2O4·xH2O沉淀是否洗涤干净的方法是____________。
(2)通常用已知浓度的酸性高锰酸钾溶液测定草酸亚铁晶体的纯度。已知酸性条件下MnO4-转化为Mn2+,写出MnO4-与Fe2+反应的离子方程式:____________。
(3)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备较纯净的FeSO4溶液,再合成FeC2O4·xH2O。请补充完整由硫铁矿烧渣制备纯净FeSO4溶液的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量硫铁矿烧渣中加入足量的稀硫酸充分反应,过滤,____________,过滤,得到较纯净的FeSO4溶液。
-
实验室以废铁屑为原料制备草酸亚铁晶体(FeC2O4·xH2O)。过程如下:
已知:①pH>4时,Fe2+易被氧气氧化
相关物质的溶解度曲线如图。
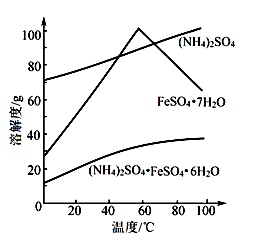
(1)①废铁屑在进行“溶解”前,需要在5%的Na2CO3溶液中加热数分钟,并洗涤干净,Na2CO3溶液的作用是 。
②用稀硫酸调溶液pH至1~2的目的:一是抑制Fe2+ 和NH4+的水解;二是 。
③操作I是为了得到(NH4)2SO4·FeSO4·6H2O,则操作I应进行蒸发浓缩、结晶、过滤。那么过滤时适宜的温度为 。
④检验FeC2O4·xH2O沉淀是否洗涤干净的方法是 。
(2)通常用已知浓度的酸性高锰酸钾溶液测定草酸亚铁晶体的纯度。已知酸性条件下MnO4-转化为Mn2+,写出MnO4-与Fe2+反应的离子方程式: 。
(3)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备较纯净的FeSO4溶液,再合成FeC2O4·xH2O。请补充完整由硫铁矿烧渣制备纯净FeSO4溶液的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量硫铁矿烧渣中加入足量的稀硫酸充分反应,过滤, ,过滤,得到较纯净的FeSO4溶液。
-
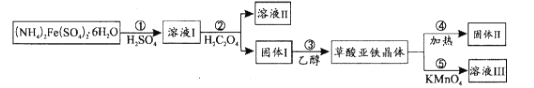
草酸亚铁晶体(FeC2O4•xH2O)在电池工业、制药、照片显影等方面有重要作用。在实验室中用制备草酸亚铁并研究其性质,具体流程如图:
已知:常温下,pH>4时,Fe2+容易被氧化;H2C2O4的Ka1=5.9×10-2,Ka2=6.5×10-5;Ksp(FeC2O4•xH2O)=3.2×10-7
回答下列问题:
(1)步骤①用水溶解的过程中,加入少量稀H2SO4的作用是_____。
(2)步骤②中加入的H2C2O4属于_____酸,生成固体I的离子反应方程式为_____。
(3)步骤③中先用水洗涤,再用乙醇洗涤,其目的是_____。
(4)步骤④是检验草酸亚铁晶体加热分解后的产物H2O、CO、CO2,首先检验的气体为_____,然后将剩余气体依次通过_____(填序号,装置可重复使用)→尾气处理。实验前需要将装置中的空气排尽,理由是_____。

(5)步骤⑤采用滴定分析法测定FeC2O4•xH2O中x的值。取0.18g样品溶于稀硫酸配成100.00mL溶液,取20.00mL于锥形瓶中,用0.0100mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液12.00mL。滴定终点的现象为_____,x值为_____。
-
水合草酸亚铁(FeC2O4·xH2O)在制药工业上有广泛应用。以莫尔盐[(NH4)2SO4·FeSO4·6H2O]为原料制备FeC2O4·xH2O,并探究其性质。回答下列问题:
已知:草酸亚铁晶体为淡黄色粉末,难溶于水,溶于稀酸;pH>4时,Fe2+容易被氧化。
I.制备FeC2O4·xH2O(如图)
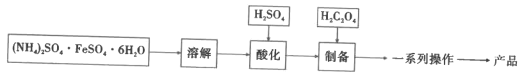
(1)加入H2SO4的目的是__。
(2)制备步骤的离子方程式是__。
(3)一系列操作是__。
II.探究FeC2O4·xH2O的分解产物:CO2、CO(如图)
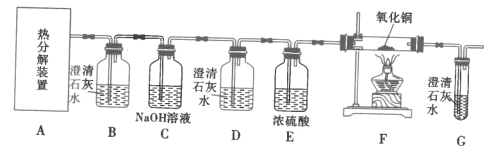
(4)装置D的作用是__,证明分解产物中存在CO的现象是__。
(5)从绿色化学角度考虑,实验存在不足之处,指出并提出解决方案:__。
III.定量测定FeC2O4·xH2O的化学式[M(FeC2O4)=144]
操作步骤:准确称取mg草酸亚铁晶体,溶于V1mL、c1mol·L-1的H2SO4溶液中,加热,用KMnO4标准溶液滴定至终点,加入锌粉将Fe3+恰好全部还原为Fe2+,然后用c2mol·L-1KMnO4标准溶液滴定至终点,记录消耗KMnO4标准溶液的体积为V2mL。
(6)第二次使用KMnO4标准溶液滴定的离子方程式为__。
(7)x=_(用字母表示)。
-
草酸亚铁晶体是一种淡黄色粉末,常用于照相显影剂及制药工业,也是电池材料的制备原料。某化学兴趣小组对草酸亚铁晶体的一些性质进行探究。
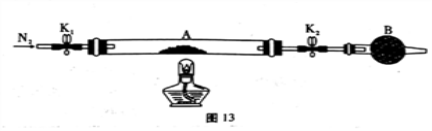
(1)甲组同学用图13所示装置测定草酸亚铁晶体(FeC2O4·xH2O)中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为ag。将样品装入石英玻璃管中,再次将装置称重,记为b g。按图连接好装置进行实验。
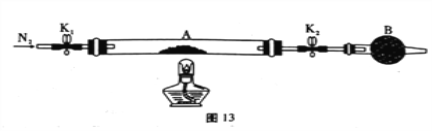
a.打开K1和K2,缓缓通入N2;
b.点燃酒精灯加热;
c.熄灭酒精灯;
d.冷却至室温;
e.关闭K1和K2;
f.称重A;
g.重复上述操作,直至A恒重,记为cg。
①仪器B的名称是____________________。
②根据实验记录,计算草酸亚铁晶体化学式中的x =____________(列式表示);若实验时a、b次序对调,会使x值______________ (填“偏大” “无影响”或“偏小”)。
(2)乙组同学为探究草酸亚铁的分解产物,将(1)中已恒重的装置A接入图14所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后装置A中残留固体为黑色粉末。
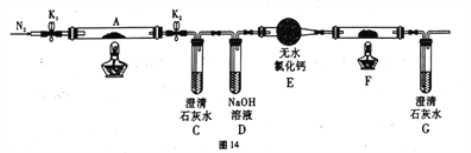
①装置C、G中的澄清石灰水均变浑浊,说明分解产物中有_______________(填化学式)。
②装置F中盛放的物质是:______________________ (填化学式)。
③将装置A中的残留固体溶于稀盐酸,无气泡,滴入KSCN溶液无血红色,说明分解产物中有:_________________ (填化学式)。
④写出草酸亚铁(FeC2O4)分解的化学方程式:______________________。
-
草酸亚铁晶体是一种淡黄色粉末,常用于照相显影剂及制药工业,也是电池材料的制备原料。某化学兴趣小组对草酸亚铁晶体的一些性质进行探究。
(1)甲组同学用图13所示装置测定草酸亚铁晶体(FeC2O4·xH2O)中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为ag。将样品装入石英玻璃管中,再次将装置称重,记为b g。按图连接好装置进行实验。
a.打开K1和K2,缓缓通入N2;
b.点燃酒精灯加热;
c.熄灭酒精灯;
d.冷却至室温;
e.关闭K1和K2;
f.称重A;
g.重复上述操作,直至A恒重,记为cg。
①仪器B的名称是____________________。
②根据实验记录,计算草酸亚铁晶体化学式中的x =____________(列式表示);若实验时a、b次序对调,会使x值______________ (填“偏大” “无影响”或“偏小”)。
(2)乙组同学为探究草酸亚铁的分解产物,将(1)中已恒重的装置A接入图14所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后装置A中残留固体为黑色粉末。
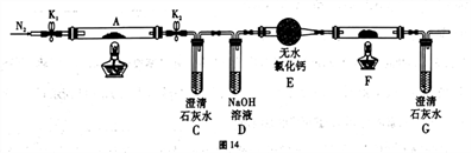
①装置C、G中的澄清石灰水均变浑浊,说明分解产物中有_______________(填化学式)。
②装置F中盛放的物质是:______________________ (填化学式)。
③将装置A中的残留固体溶于稀盐酸,无气泡,滴入KSCN溶液无血红色,说明分解产物中有:_________________ (填化学式)。
④写出草酸亚铁(FeC2O4)分解的化学方程式:______________________。
-
草酸亚铁(FeC2O4·nHO)溶解度冷水中0.22g,热水中0.026g,具有强还原性,常用作分析试剂及显影剂。某化学小组利用工业废铁屑设计如下装置制备草酸亚铁晶体。回答下列问题:
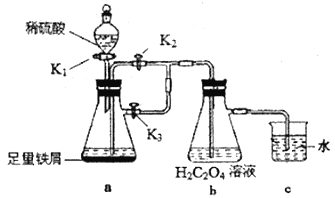
(1)实验前需将废铁屑在5%的Na2CO3溶液中加热并用蒸馏水洗涤干净,则Na2CO3溶液的作用是___________。
(2)组装好装置后首先需要检验装置的气密性,其方法是______________________。实验过程中装置c的作用是______________________。
(3)实验过程:在相应装置添加试剂后,需要让a瓶中反应先进行一段时间以排除空气,进行的操作是打开K1将一定量稀硫酸加入a瓶后关闭K1,同时还要进行的操作是___________,一段时间后,需要将a装置中的硫酸亚铁溶液导入装置b中,其操作是___________。
(4)b中生成的沉淀需过滤、洗涤、干燥,洗涤时最好选用下列试剂中的___________(填序号)。检验洗涤干净的方法是___________。
a.硫酸 b.冷水 c热水
(5)准确称取9g草酸亚铁晶体(FeC2O4·nH2O)于锥形瓶中,加入一定量硫酸溶解并加热至50℃,然后用1.0mol·L-1的KMnO4标准溶液滴定,达到滴定终点时用去30mL标准溶液。滴定反应为:10(FeC2O4·nH2O)+6KMnO4+24H2SO4=5Fe2(SO4)3+20CO2↑+6MnSO4+3K2SO4+(24+10n)H2O。
①判断滴定终点的依据为___________。②n=___________。
-
水合草酸亚铁(FeC2O4·xH2O) 是生产锂电池的原料。难溶于水,受热易分解。某化学兴趣小组对草酸亚铁的一些性质进行探究。回答下列问题:
(1)实验室用硫酸亚铁溶液和草酸制备水合草酸亚铁,反应的化学方程式为___________。
(2)将水合草酸亚铁溶于适量盐酸。分别取2mL此溶液于3支试管中,进行实验:能证明水合草酸亚铁中存在Fe2+的试剂有______(填代号)。
A.KSCN 溶液 B.K3[Fe(CN)6]溶液 C.酸性KMnO4溶液
(3)为测定水合草酸亚铁中结晶水含量,将石英玻璃管(带两端开关K1和K2) (设为装置A) 称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2 g。按下图连接好装置进行实验。
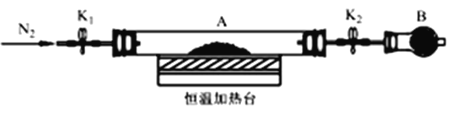
实验步骤如下:
a.打开K1和K2,缓缓通入N2;
b.低温加热装置A一段时间;
c.停上加热,冷却到室温;
d.关闭K1和K2,称量A;
e._______________,记为m3g。
①补充实验步骤e 为____________________(填实验操作和要求)。
②步骤b至步骤e继续通入N2的目的是______________________________________。
③根据实验数据记录,计算水合草酸亚铁化学式中结晶水数目x=________(列式表示)。
(4)为探究草酸亚铁的分解产物,将(3) 中已恒重的装置A接入下图所示部分的装置(可重复选用)进行实验。打开K1和K2,缓缓通入N2,充分加热。实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物。
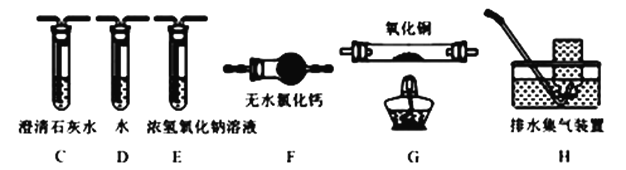
①实验装置中,依次连接的合理顺序为A→___________________________。
②证明产物有CO生成的现象是__________________________________。
③写出草酸亚铁受热分解的化学方程式为_________________________________。
-
水合草酸亚铁(FeC2O4·xH2O)是生产锂电池的原料,难溶于水,受热易分解。某化学兴趣小组对草酸亚铁的一些性质进行探究。回答下列问题:
(1)实验室用硫酸亚铁溶液和草酸制备水合草酸亚铁,反应的化学方程式是_________。
(2)将水合草酸亚铁溶于适量盐酸。分别取2 mL此溶液于3支试管中,进行实验:
①第一支试管中加入几滴KSCN溶液,溶液不变红;
②第二支试管中加入几滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入几滴酸性KMnO4溶液,溶液紫红色褪去。
上述实验能证明水合草酸亚铁中存在Fe2+的是_________(填编号)。
(3)为测定水合草酸亚铁中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2 g。按下图连接好装置进行实验。
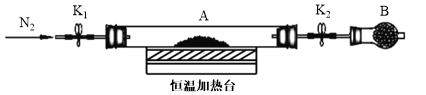
验步骤如下:a.打开K1和K2,缓缓通入N2;b.加热装置A一段时间;c.停止加热,冷却到室温;d.关闭K1和K2,称量A;e.重复上述步骤,直至A恒重,记为m3 g。
①步骤b至步骤c继续通入N2的目的是 ________________。
②根据实验数据记录,计算水合草酸亚铁化学式中结晶水数目x=______(列式表示)。
(4)为探究草酸亚铁的分解产物,将(3)中已恒重的装置A接入下图所示部分的装置(可重复选用)进行实验。打开K1和K2,缓缓通入N2,充分加热。实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物。
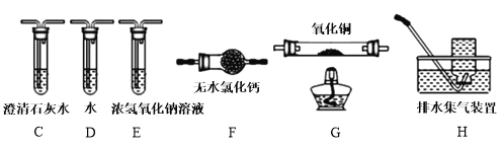
①写出草酸亚铁受热分解的化学方程式____________。
②实验装置中,依次连接的合理顺序为A、____________。
-
水合草酸亚铁(FeC2O4·xH2O)是生产锂电池的原料,难溶于水,受热易分解。某化学兴趣小组对草酸亚铁的一些性质进行探究。回答下列问题:
(1)实验室用硫酸亚铁溶液和草酸制备水合草酸亚铁,反应的化学方程式是_________。
(2)将水合草酸亚铁溶于适量盐酸。分别取2 mL此溶液于3支试管中,进行实验:
①第一支试管中加入几滴KSCN溶液,溶液不变红;
②第二支试管中加入几滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入几滴酸性KMnO4溶液,溶液紫红色褪去。
上述实验能证明水合草酸亚铁中存在Fe2+的是_________(填编号)。
(3)为测定水合草酸亚铁中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2 g。按下图连接好装置进行实验。
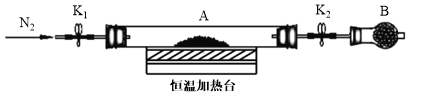
验步骤如下:a.打开K1和K2,缓缓通入N2;b.加热装置A一段时间;c.停止加热,冷却到室温;d.关闭K1和K2,称量A;e.重复上述步骤,直至A恒重,记为m3 g。
①步骤b至步骤c继续通入N2的目的是 ________________。
②根据实验数据记录,计算水合草酸亚铁化学式中结晶水数目x=______(列式表示)。
(4)为探究草酸亚铁的分解产物,将(3)中已恒重的装置A接入下图所示部分的装置(可重复选用)进行实验。打开K1和K2,缓缓通入N2,充分加热。实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物。
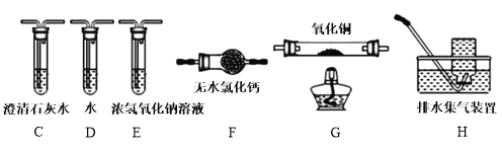
①写出草酸亚铁受热分解的化学方程式____________。
②实验装置中,依次连接的合理顺序为A、____________。


















