-
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族。 E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 。
(2)E2+离子的价层电子排布图是 ,F原子的电子排布式是 。
(3)A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,B元素的气态氢化物的VSEPR模型为 。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为 。
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程为 。
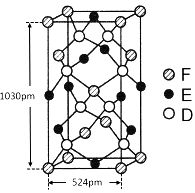
(6)某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为 ,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度d= g/cm3。(保留两位小数)
-
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大,A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族,E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号 ______ ,该能层具有的原子轨道数为 ______。
(2)E2+离子的价层电子排布图是 ______ ,F原子的电子排布式是 ______ 。
(3)A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ______ ,B元素的气态氢化物的VSEPR模型为 ______ 。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为 ______ 。
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为 ______ 。
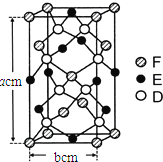
(6)某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为 ______,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度d= ______ g/cm3(列出计算式,无需计算)。
-
【化学—选修3物质结构与性质】(15分)
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族。 E、F都是第四周期元素,
E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有
1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 。
(2)E2+离子的价层电子排布图是 ,F原子的电子排布式是 。
(3)A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,B元素的气态氢化物的VSEPR模型为 。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为 。
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程为 。
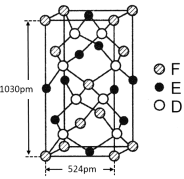
(6)某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为 ,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度d= g/cm3。(保留两位小数)
-
【化学—选修3物质结构与性质】(15分)
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族。 E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 。
(2)E2+离子的价层电子排布图是 ,F原子的电子排布式是 。
(3)A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,B元素的气态氢化物的VSEPR模型为 。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为 。
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程为 。
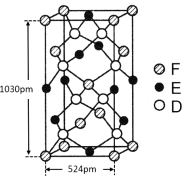
(6)某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为 ,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度d= g/cm3。(保留两位小数)
-
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中基态A原子价电子排布式为nsnnpn;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素基态原子没有不成对电子;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层只有1个电子,其余各内层轨道均充满电子。请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
(1)C的同周期相邻元素的第一电离能由小到大的顺序为______
(2)氢化物A2H4分子中A原子采取______杂化
(3)元素F在周期表的位置为______,E的气态氢化物通入二价阳离子F2+的水溶液反应的离子方程式为______
(4)元素A和D可形成一种无机非金属材料,其晶体具有很高的硬度和熔点,其化合物中所含的化学键类型为______(从原子轨道重叠方式看),A、D的最高价氧化物的熔沸点大小顺序_________;原因________。
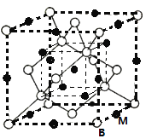
(5)B与同主族原子半径最小的元素M形成的晶胞结构所示的立方晶胞,则其化学式为______。设阿伏加德罗常数为NA,距离最近的两个B、M原子的核间距为a nm,则该化合物的晶胞密度为(用含a和NA的代数式表示)______g/cm3
-
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大。其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子。请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
(1)A、B、E的第一电离能由小到大的顺序为 。
(2)B的氯化物的熔点比D的氯化物的熔点 (填“高”或“低”)。
(3)氢化物A2H4分子中A原子采取 杂化。
(4)按原子的外围电子排布分区,元素F在 区,二价阳离子F2+与过量的A的简单氢化物的水溶液反应的离子方程式为 。
(5)元素A和C可形成一种新型化合物材料,其晶体具有很高的硬度和熔点,其化合物中所含的化学键类型为 。
(6)A、F形成某种化合物的晶胞结构如右图所示的立方晶胞(其中A显-3价,每个球均表示1个原子),则其化学式为 。设阿伏伽德罗常数为NA,距离最近的两个F原子的核间距为a cm,则该化合物的晶胞密度为(用含a和NA的代数式表示) g/cm3。

-
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
(1)A、B、E的第一电离能由小到大的顺序为 .
(2)氢化物A2H4分子中A原子采取 杂化.
(3)按原子的外围电子排布分区,元素F在 区,二价阳离子F2+与过量的A的简单氢化物的水溶液反应的离子方程式为 .
(4)元素A和C可形成一种新型化合物材料,其晶体具有很高的硬度和熔点,其化合物中所含的化学键类型为 .
(5)A、F形成某种化合物的晶胞结构如右图所示的立方晶胞(其中A显﹣3价,每个球均表示1个原子),则其化学式为 .设阿伏伽德罗常数为NA,距离最近的两个F原子的核间距为a cm,则该化合物的晶胞密度为(用含a和NA的代数式表示) g/cm3.

-
A、B、C是短周期非金属元素,核电荷数依次增大。A原子外围电子排布为ns2np2,C是地壳中含量最多的元素。D、E是第四周期元素,其中E元素的核电荷数为29。D原子核外未成对电子数在同周期中最多。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子结构,其结构式为 ,1mol该分子中含有 键的数目为 。
键的数目为 。
(3)基态D原子的外围电子排布式为 。DO2Cl2熔点:-96 .5℃,沸点:117℃,则固态DO2Cl2属于 晶体。
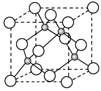
(4)E的氢化物的晶胞结构如图所示,其化学式是 。

-
A、B、C是短周期非金属元素,核电荷数依次增大。A原子外围电子排布为ns2np2,C是地壳中含量最多的元素。D、E是第四周期元素,其中E元素的核电荷数为29。D原子核外未成对电子数在同周期中最多。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为________。
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为________,1mol该分子中含有 键的数目为________。
键的数目为________。
(3)基态D原子的外围电子排布式为________。DO2Cl2熔点:-96 .5℃,沸点:117℃,则固态DO2Cl2属于________晶体。
(4)E的氢化物的晶胞结构如图所示,其化学式是________。
-
短周期非金属元素A、B、C的核电荷数依次增大,A原子的外围电子排布式为ns2np2,C是地壳中含量最多的元素。元素D、E都位于第四周期,其中E的核电荷数为29,D原子的核外未成对电子数在同周期中是最多的。请用对应的元素符号或化学式填空:
(1)元素A、B、C的第一电离能由小到大的顺序为________。
(2)已知(AB)2分子中键与键之间的夹角为180°,并有对称性,且每个原子的最外层电子数均满足8电子结构,则其结构式为________,1 mol该分子中含有的π键的数目为________。
(3)基态D原子的外围电子排布式为________。化合物DO2Cl2的熔点是-96.5 ℃,沸点是117 ℃,则固态DO2Cl2属于________晶体。
(4)已知元素E的氢化物的晶胞结构如图所示,则其化学式为___________________。










