-
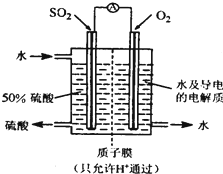
某研究组设想以如图所示装置用电化学原理生产硫酸。关于该装置的叙述正确的是
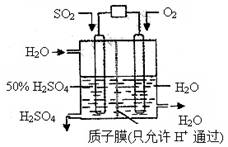
A.该装置为原电池,通入O2的电极是负极
B.该装置中,通入SO2的电极的电极反应式为:SO2+O2-+H2O -2e- =2H++SO42-
C.该装置中,H+通过质子膜向左侧移动
D.在标准状况下,理论上每消耗11.2L SO2,则可产生0.5mol H2SO4
【解析】氧气是得电子得,所以氧气在正极通入。SO2在反应中失去电子,在负极通入,所失去得电子经导线传递到正极上,所以溶液中得阳离子向正极移动。因为交换膜只允许氢离子通过,所以负极得电极反应式为SO2+2H2O -2e-=4H++SO42-。所以正确的答案是D。
-
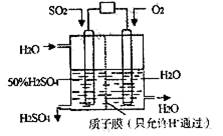
某研究组设想以如图所示装置用电化学原理生产硫酸。关于该装置的叙述正确的是
A.该装置为原电池,通入O2的电极是负极
B.该装置中,通入SO2的电极的电极反应式为:SO2-2e-+O2-+H2O=2H++SO42-
C.该装置中,H+通过质子膜向左侧移动
D.在标准状况下,理论上若通入SO2速率为2.24 L·min-1,则通入O2速率应为1.12 L·min-1
-
某研究组设想以如图所示装置用电化学原理生产硫酸。关于该装置的叙述正确的是
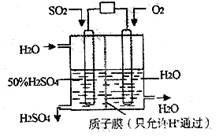
A.该装置为原电池,通入O2的电极是负极
B.该装置中,通入SO2的电极的电极反应式为:SO2-2e-+O2-+H2O=2H++SO42-
C.该装置中,H+通过质子膜向左侧移动
D.在标准状况下,理论上若通入SO2速率为2.24 L·min-1,则通入O2速率应为1.12 L·min-1
-
一种新型的利用电化学反应原理来制备硫酸的方法已经问世,其装置如图所示,电极为多孔的惰性电极,稀硫酸作电解质溶液,电池工作时,一极通入SO2气体,另一极通入O2。下列有关叙述正确的是
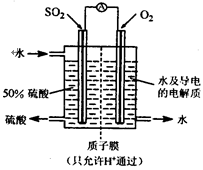
A.通入O2的电极为负极
B.正极反应式为:O2+4e-+2H2O=4OH-
C.电池工作时H+移向负极
D.负极反应式为:2SO2 - 4e- + 4H2O = 2SO42- + 8H+
-
一种新型的利用电化学反应原理来制备硫酸的方法已 经问世,其装置如图所示,电极为多孔的惰性电极,稀硫酸作电解质溶液,电池工作时,一极通入SO2气体,另一极通入O2.下列有关叙述正确的是( )
A.通入O2的电极为负极
B.正极反应式为:O2+4e-+2H2O=4OH-
C.电池工作时H+移向负极
D.负极反应式为:2SO2-4e-+4H2O=2SO42-+8H+
-
膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。
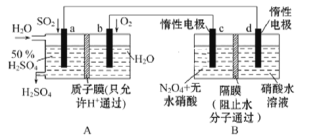
(1)A装置是________(填“原电池”或“电解池”),A装置中通入SO2一极的电极反应式为________________________________________。
(2)N2O5在电解池的________(填“c极”或“d极”)区生成,其电极反应式为____________。
-
科研人员设想用如图所示装置生产硫酸,下列说法正确的是( )
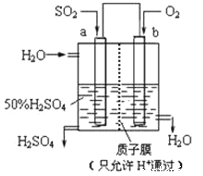
A. a为正极,b为负极
B. 生产过程中a电极质量减轻
C. 电子从b极向a极移动
D. 负极反应式为:SO2+2H2O﹣2e﹣=SO42﹣+4H+
-
科研人员设想用如图所示装置生产硫酸,下列说法正确的是
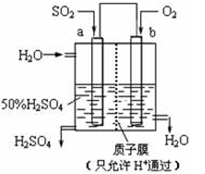
A.A为正极,B为负极
B.生产过程中A电极质量减轻
C.电子从B极向A极移动
D.负极反应式为:SO2-2e-+ 2H2O = SO42-+ 4H+
-
下列关于铜电极的叙述中正确的是
A.铜锌原电池中铜是负极
B.用电解法精炼粗铜时粗铜作阳极
C.在铁上电镀铜时用铜作阴极
D.电解稀硫酸时用铜作阳极,阳极产生氧气
-
下列关于铜电极的叙述中正确的是
A.用电解法精炼粗铜时纯铜作阴极
B.在铁上电镀铜时用铜作阴极
C.铜锌原电池中铜是负极
D.电解稀硫酸时用铜作阳极,阳极产生氧气







