-
已知:①CO(g)+H2O(g) CO2(g)+H2(g);△H1=-41.2kJ/mol
CO2(g)+H2(g);△H1=-41.2kJ/mol
②CH4(g)+CO2(g) 2CO(g)+2H2(g);△H2=+247.3kJ/mol
2CO(g)+2H2(g);△H2=+247.3kJ/mol
③CH4(g)+H2O(g) CO(g)+3H2(g);△H3
CO(g)+3H2(g);△H3
若反应③在体积一定的密闭容器中进行,测得CH4的物质的量溶液随反应时间的变化如图所示。下列有关叙述错误的是

A.△H3=+206.1 kJ/mol
B.反应③进行到10 min时,改变的外界条件可能是升高温度
C.反应③进行的过程中,0~5min这段时间共吸收的热量为103.05kJ
D.当反应③平衡后,向容器中通入CH4,平衡向正反应方向移动,CH4的转化率将增大
-
(1) 已知: CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1 = akJ/mol;
CO(g) + H2O (g)=CO2(g) + H2 (g) △H2 = bkJ/mol;
2CO(g) + O2(g)= 2CO2(g) △H3 = ckJ/mol;
反应CO2(g)+ CH4(g)=2CO(g) + 2H2(g) 的△H = _____kJ/mol;
(2) 科学家用氮化镓材料与铜组装如图10的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。
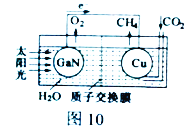
①写出铜电极表面的电极反应式_____________。
②为提高该人工光合系统的工作效率,可向装置中加入少量_______ (选填“盐酸”或“硫酸”)。
(3) 天然气中的H2S 杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS 溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式___________。
(4) 将甲烷和硫反应可以制备CS2,其流程如图11所示:
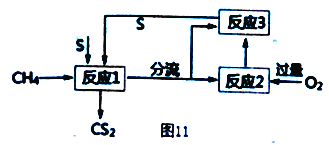
①写出发生反应1的化学反应方程式___________。
②反应1产生两种含硫的物质,为了提高CS2的产率,设计反应2和3实现硫单质循环利用,实验时需对反应1出来的气体分流,则进入反应2 和反应3 的气体物质的量之比为___________。
③当反应1中每有1molCS2生成时,反应2中需要消耗O2的物质的量为___________。
-
已知:
① CO(g)+ H2O(g) CO2(g)+ H2(g);△H1=-41.2kJ·mol-1
CO2(g)+ H2(g);△H1=-41.2kJ·mol-1
② CH4(g)+ CO2(g) 2CO(g)+ 2H2(g);△H2=+247.3kJ·mol-1
2CO(g)+ 2H2(g);△H2=+247.3kJ·mol-1
③ CH4(g)+ H2O(g) CO(g)+ 3H2(g);△H3
CO(g)+ 3H2(g);△H3
若反应③在1L的密闭容器中进行,测得CH4的物质的量浓度随反应时间的变化如图所示。下列有关叙述错误的是( )
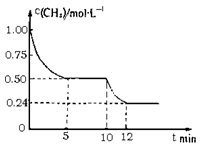
A △H3=+206.1 kJ·mol-1
B 反应③进行到10min时,改变的外界条件可能是升高温度
C 反应③进行的过程中,0~5min这段时间共吸收的热量为103.05kJ
D 当反应③平衡后,向容器中通入CH4,平衡向正反应方向移动,CH4的转化率将增大
-
煤燃烧后的主要产物是CO、CO2。
(1)已知: ①C(s)+H2O(g)=CO(g)+H2(g) △H1=+131.3kJ·mol-1
②C(s)+2H2O(g)=CO2(g)+2H2(g) △H2=+90.0kJ·mol-1
③CO2(g)+H2(g) = CO(g)+H2O(g) △H3=________。
⑵以CO2为原料可制备甲醇:CO2(g)+3H2(g)=CH3OH(g) + H2O(g) △H =-49.0 kJ·mol-1,向1 L的恒容密闭容器中充入1 mol CO2 (g)和3 mol H2(g),测得CO2 (g)和CH3OH(g)浓度随时间的变化如图1所示。

①0〜8 min内,以氢气表示的平均反应速率v(H2)=_____mol • L-1• min-1。
②在一定条件下,体系中CO2的平衡转化率(a)与L和X的关系如图2所示,L和X分别表示温度或压强。X表示的物理量是______(填“温度”或“压强”),L1____(填“〉”或“ <”)L2。
(3)向一体积为20 L的恒容密闭容器中通入1 mol CO2发生反应:2 CO2(g) 2CO(g)+ O2 (g),在不同温度下各物质的体积分数变化如图3所示。
2CO(g)+ O2 (g),在不同温度下各物质的体积分数变化如图3所示。
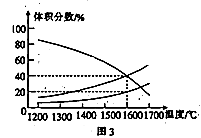
1600℃时反应达到平衡,则此时反应的平衡常数K=_______。
-
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3 kJ·mol-1;H2(g)+O2(g)=H2O(l) ΔH2=-285.8 kJ·mol-1。CO2气体与H2气体反应生成甲烷气体与液态水的热化学方程式为CO2(g)+4H2(g)=CH4(g)+2H2O(l)ΔH3,其中ΔH3的数值为( )
A.-252.9 kJ·mol-1 B.+252.9 kJ·mol-1
C.-604.5 kJ·mol-1 D.+604.5 kJ·mol-1
-
已知:H2O(g)=H2O(l) △H1=-Q1 kJ/mol;
C2H5OH(g)=C2H5OH(l) △H2=-Q2 kJ/mol;
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3 kJ/mol。
则酒精的燃烧热为
A.2(Q1+Q2+Q3)kJ/mol B.(Q1+Q2+Q3 ) kJ/mol
C.(Q1-Q2+Q3 ) kJ/mol D.(3Q1-Q2+Q3 ) kJ/mol
-
关于下列各图的叙述中不正确的是

A.已知CO的燃烧热为283 kJ/mol,2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol,则图甲表示CO和H2O(g)生成CO2和H2的能量变化
B.某温度下,pH=11的NH3·H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+ 、NH3·H2O与NH3三种微粒的平衡浓度之和为0.05 mol·L-1
C.在常温下,X2(g)和H2反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐降低,且X2与H2反应的剧烈程度逐渐减弱
D.图乙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,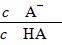 的变化情况
的变化情况
-
(1)已知:① CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
② C(s)+2H2(g) CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③ 2CO(g) C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
则CO2(g)+4H2(g)  CH4(g)+2H2O(g) ΔH=_________________。
CH4(g)+2H2O(g) ΔH=_________________。
(2)其他条件相同时,CO和H2按物质的量比1:3进行反应:
CO(g)+3H2(g) CH4(g)+H2O(g)
CH4(g)+H2O(g)
H2的平衡转化率在不同压强下,随温度的变化如图所示。

①实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由______________________________。
②M点的平衡常数Kp=_____________________。(只列算式。Kp的表达式是将平衡分压代替平衡浓度。某物质的平衡分压=总压×该物质的物质的量分数)
(3)下图表示在一定条件下的1 L的密闭容器中, X、Y、C三种气体因发生反应,三种气体的物质的量随时间的变化情况。下表是3 mol X和1mol Y在一定温度和一定压强下反应,达到平衡时C的体积分数(C%)。
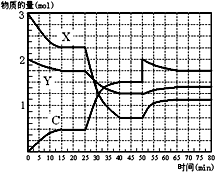

①X、Y、C三种气体发生反应的化学方程式为_________________________。
②表中a的取值范围是________________________________。
③根据上图和上表分析,25 min~40 min内图中曲线发生变化的原因可能是________。
(4)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐.己知:25℃时,几种酸的电离平衡常数如下表所示。
| H2CO3 | H2SO3 | HNO2 | HClO |
| K1=4.4×10-7 K2=4.7×10-11 | K1=1.2×10-2 K2=6.6×10-8 | K=7.2×10-4 | K=2.9×10-8 |
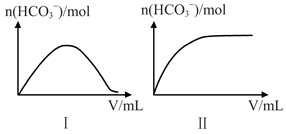
25℃时,向一定浓度的Na2CO3溶液中分别滴入等物质的量浓度的下列溶液至过量:
①NaHSO3、②HNO2、③HC1O,溶液中的n (HCO3-)与所加入溶液体积(V)的关系如上图所示。其中符合曲线Ⅱ的溶液为__________。
-
(1)煤气化制合成气(CO和H2)
已知:C(s)+H2O(g)===CO(g)+H2(g)ΔH2=131.3kJ·mol−1
C(s)+2H2O(g)===CO2(g)+2H2(g)ΔH2=90kJ·mol−1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是_____
(2)由合成气制甲醇
合成气CO和H2在一定条件下能发生反应:CO(g)+2H2(g) CH3OH(g)ΔH<0。
CH3OH(g)ΔH<0。
①在容积均为VL的甲、乙、丙、丁四个密闭容器中分别充入amolCO和2amolH2,四个容器的反应温度分别为T1、T2、T3、T4且恒定不变。在其他条件相同的情况下,实验测得反应进行到tmin时H2的体积分数如图所示,则T3温度下的化学平衡常数为_____(用a、V表示)

②图反映的是在T3温度下,反应进行tmin后甲醇的体积分数与反应物初始投料比 的关系,请画出T4温度下的变化趋势曲线。______________
的关系,请画出T4温度下的变化趋势曲线。______________
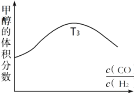
③在实际工业生产中,为测定恒温恒压条件下反应是否达到平衡状态,可作为判断依据的是_____
A.容器内气体密度保持不变 B.CO 的体积分数保持不变
C.气体的平均相对分子质量保持不变 D.c(H2)=2c(CH3OH)
(3)由甲醇制烯烃
主反应:2CH3OH C2H4+2H2O i;
C2H4+2H2O i;
3CH3OH C3H6+3H2O ii
C3H6+3H2O ii
副反应:2CH3OH CH3OCH3+H2O iii
CH3OCH3+H2O iii
某实验室控制反应温度为400℃,在相同的反应体系中分别填装等量的两种催化剂(Cat.1和Cat.2),以恒定的流速通入CH3OH,在相同的压强下进行甲醇制烯烃的对比研究,得到如下实验数据(选择性:转化的甲醇中生成乙烯和丙烯的百分比)
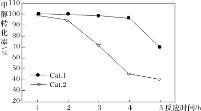
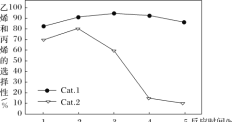
由图像可知,使用Cat.2反应2h后甲醇的转化率与乙烯和丙烯的选择性均明显下降,可能的原因是(结合碰撞理论解释)_____
-
CO2和甲烷催化合成CO和H2是CO2资源化利用的有效途径。主要反应为
Ⅰ:CH4(g)+CO2(g)  2CO(g)+2H2(g) △H=+247kJ/mol
2CO(g)+2H2(g) △H=+247kJ/mol
(1)已知CH4(g)+H2O(g)  CO(g)+H2(g) △H=+206kJ/mol
CO(g)+H2(g) △H=+206kJ/mol
写出CH4和水蒸气反应生成CO2的热化学方程式_________。
(2)在恒温、恒容的密闭容器中发生反应I,下列选项能够说明反应I达到平衡状态的是______。
A.混合气体的密度不变
B.混合气体的总压强不变
C.CH4、CO2、CO、H2的物质的量之比为1:1:2:2
D.3V正(H2)=V逆(CH4)
E.混合气体的平均相对分子质量不变
(3)催化合成的温度通常维持在550-750℃之间,从反应速率角度分析其主要原因可能是_________。
(4)将CH4与CO2各1mol充入某密闭容器中,发生反应I。100Kpa时,反应I到达平衡时CO2的体积分数与温度的关系曲线如图所示。
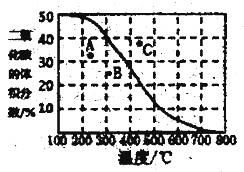
①图中A、B、C三点表示不同温度、压强下达到平衡时CO2的体积分数,则______点对应的平衡常数最小,判断依据是________;__________点对应的压强最大。
②300℃,100Kpa下,该容器中反应I经过40min达到平衡,计算反应在0-40min内的平均反应速率为v(CO2)=_________mol/min(结果保留两位有效数字),该温度下的压强平衡常数Kp=________。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
CH4(g)+2H2O(g) ΔH=_________________。
CH4(g)+H2O(g)











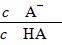 的变化情况
的变化情况



