-
氯化亚铜(CuCl2)是一种重要的催化剂。实验室按如下装置和方案制备氯化亚铜(已知:Cu2++6Cl―+ Cu=2CuCl32-)
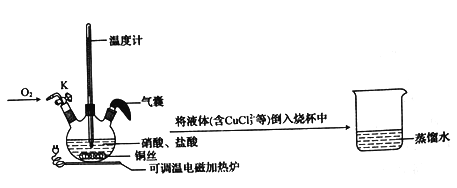
实验步骤:
①加热至50℃,铜丝表面产生无色气泡,液面上方有红棕色气体产生;
②通入并调节氧气的量维持三颈瓶内压强不变。停止加热,反应继续进行,越来越剧烈;
③反应停止后冷却至室温,待气囊变瘪。瓶内红棕色气体消失时关闭K;
④将液体(含CuCl32-等)转移至烧杯中用蒸馏水稀释,产生白色沉淀,过滤得氯化亚铜粗品和滤液;
⑤氯化亚铜粗品经洗涤、烘干,得到氯化亚铜。
回答下列问题:
(1)写出步骤①中铜丝表面产生无色气泡的化学方程式_________。
(2)步骤②中停止加热后,反应越来越剧烈的原因是_______。
(3)步骤③中瓶内红棕色气体消失的原因是_______。(结合化学方程式回答)
(4)步骤④中产生白色沉淀的离子方程式是_________。
(5)步骤④所得滤液经浓缩后可返回至三颈瓶继续使用,此时需向三颈瓶内补充的物质有____。
-
氯化铜晶体是重要的化工原料,可用作催化剂、消毒剂等.用孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]制备氯化铜晶体,方案如下:
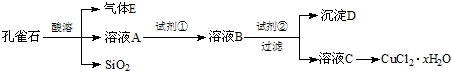
已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:
| Fe3+ | Cu2+ | Fe2+ |
| 开始沉淀的pH | 2.7 | 5.4 | 8.1 |
| 沉淀完全的pH | 3.7 | 6.9 | 9.6 |
(1)若溶液A含有的金属离子有Cu2+、Fe2+、Fe3+,则试剂①选用________(填字母).
A.Cu B.Cl2 C.NH3•H2O D.NaOH
(2)加入试剂②的目的是调节pH至a,a的范围是________.由溶液C获得CuCl2•xH2O,包含4个基本实验操作,这4个基本实验操作依次是________、________过滤和无水乙醇洗涤等操作,使用无水乙醇代替水进行洗涤的主要原因是________.
(3)为了测定制得的氯化铜晶体中x值,有同学设计了如下两种实验方案:
①称取一定质量的晶体加热使其失去结晶水,称量所得无水CuCl2的质量.该方案存在的问题是________.
②称取a g晶体、加入足量氢氧化钠溶液,过滤、洗涤、加热沉淀至质量不再减轻为止,称量所得固体的质量为b g.则x=________(用含a、b的代数式表示).
-
CuCl2、CuCl是重要的化工原料,广泛地用作有机合成催化剂。实验室中以粗铜(含杂质Fe)为原料,一种制备铜的氯化物的流程如下:
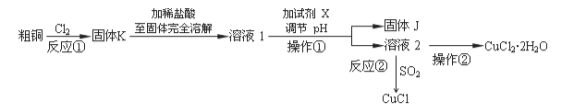
请回答下列问题:
(1)如图装置进行反应①,导管a通入氯气
(夹持仪器和加热装置省略)。观察到的现象是 ,
写出铜与氯气反应的化学方程式 。
(2)上述流程中固体K溶于稀盐酸的目的是 。
试剂X、固体J的物质最好分别为 。
a.NaOH Fe(OH)3 b.NH3·H2O Fe(OH)2
c.CuO Fe(OH)3 d.CuSO4 Cu(OH)2
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式 。
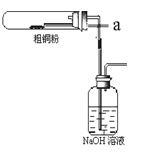
(4)反应后,如图盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该红褐色沉淀的主要化学式是 。该腐蚀过程的正极反应式为 。
(5)以石墨为电极,电解CuCl2溶液时发现阴极上也会有部分CuCl析出,写出此过程中阴极上的电极反应式 。
-
氯化亚铜(CuCl)在生产中广泛用作催化剂、杀菌剂、脱色剂。某兴趣小组采用加热分解氯化铜晶体(CuCl2·xH2O)的方法制备CuCl,其装置如下(夹持仪器省略)。

已知:
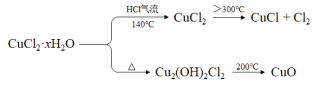
完成下列填空:
(1)在实验过程中,可以观察到C中试纸的颜色变化是___________________________。
(2)实验过程中需要全程通入干燥的HCl,其作用是___________________________。
(3)反应结束后,取出CuCl产品进行实验,发现其中含有少量的杂质,根据已知信息
① 若杂质是CuCl2,则产生的原因可能是____________________________________。
② 若杂质是CuO,则产生的原因可能是_____________________________________。
(4)为测定原料CuCl2·xH2O中结晶水的数目x,可采取如下方案:
a.用电子天平称取一定质量氯化铜晶体 b.在______(填仪器名称)中充分灼烧
c.在干燥器中冷却 d.称量所得黑色固体质量
e.重复b ~ d操作直至_____________________
① 完成上述实验操作步骤。
② 若氯化铜晶体质量为3.384 g,最终得到黑色固体质量为1.600 g,则x =________(精确到0.1)。
③ 若称量操作无误,但最终测定结果的相对误差为1.5%,写出可能导致该结果的一种情况。____________________________
-
氯化亚铜(CuCl)在生产中广泛用作催化剂、杀菌剂、脱色剂。某兴趣小组采用加热分解氯化铜晶体(CuCl2·xH2O)的方法制备CuCl,其装置如下(夹持仪器省略)。

已知:
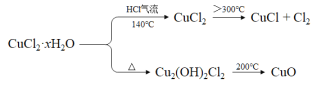
完成下列填空:
(1)在实验过程中,可以观察到C中试纸的颜色变化是___________________________。
(2)实验过程中需要全程通入干燥的HCl,其作用是___________________________。
(3)反应结束后,取出CuCl产品进行实验,发现其中含有少量的杂质,根据已知信息
① 若杂质是CuCl2,则产生的原因可能是____________________________________。
② 若杂质是CuO,则产生的原因可能是_____________________________________。
(4)为测定原料CuCl2·xH2O中结晶水的数目x,可采取如下方案:
a.用电子天平称取一定质量氯化铜晶体 b.在______(填仪器名称)中充分灼烧
c.在干燥器中冷却 d.称量所得黑色固体质量
e.重复b ~ d操作直至_____________________
① 完成上述实验操作步骤。
② 若氯化铜晶体质量为3.384 g,最终得到黑色固体质量为1.600 g,则x =________(精确到0.1)。
③ 若称量操作无误,但最终测定结果的相对误差为1.5%,写出可能导致该结果的一种情况。____________________________
-
实验室以H2O2作氧化剂,在大量氨和氯化铵存在下,选择活性炭作为催化剂制备三氯化六氨合钴(III)配合物(活性的二价钴氨配合物氧化为惰性的三价钴氨配合物)的流程如下:
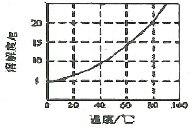
已知:Co(NH3)6Cl3在不同温度下水中的溶解度曲线如图。
(一)三氯化六氨合钴(III)配合物的制备
(1)步骤②中要冷却至10℃再缓慢地边搅拌边加入H2O2溶液,这样操作的目的是:________。
(2)实验室制备三氯化六氮合钴(III)总反应化学方程式为:_______________________。
(3)实验操作1为______________。操作2在[Co(NH3)6]Cl3溶液中加入浓盐酸的目的是____________________________________________。
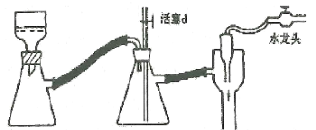
(4)实验中用到减压抽滤装置如图,当抽滤完毕或中途停止抽滤时,应当采取的正确操作过程是_________________。
(二)产品中NH3含量的测定
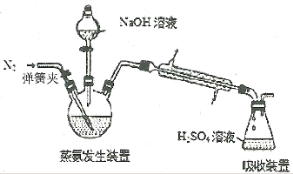
现称取0.1000g产品,在三颈烧瓶中发生如下反应:
[Co(NH3)x]Cl3+3NaOH=Co(OH)3↓+xNH3↑+3NaCl(见下图),锥形瓶中装有10.00mL c mol·L-1 H2SO4,加热烧瓶,使NH3完全逸出。滴加2滴指示剂,用0.5000mol·L-1 NaOH标准溶液滴定,滴定达到终点时消耗NaOH溶液V mL。
(5)下列关于实验的说法不正确的是______________。
A.第①步需在NH4Cl溶液中加入研细的CoCl2·6H2O晶体,目的是加速固体的溶解
B.原料NH4Cl的主要作用是抑制NH3·H2O的电离,有利于生成二价钴氨配合物,不形成Cu(OH)2
C.减压过滤涉及转移溶液,具体是:用倾析法先转移溶液,后开大水龙头,待溶液快流尽时再转移沉淀
D.第④步中使用含有盐酸的沸水,促进产品的析出
E.滴定时加入的2滴指示剂是酚酞
(6)根据实验(二)的数据计算:晶体中NH3的质量分数为__________(用含字母的式子表示)。
-
氯化亚铜(CuCl) 为白色粉末,其露置于空气中易被氧化为绿色的碱式氯化铜Cu2(OH)3Cl]。某兴趣小组高温加热分解氯化铜晶体(CuCl2·xH 2O)制备CuCl,其装置如下(加热仪器、夹持仪器省略)
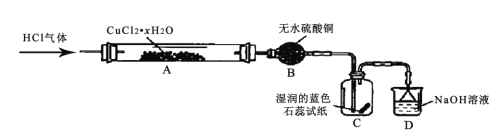
回答下列问题:
(1)装有无水硫酸铜的仪器名称为______,装置 D 的作用是______。
(2)通入 HCl 气体的主要作用是______。
(3)实验过程中,装置C 中的现象为______。
(4)硬质玻璃管A 中发生主要反应的化学方程式为__________。
(5)为测定 CuCl2·xH 2O 中结晶水的数目 x,实验步骤如下:
a 用电子天平称取一定质量的氯化铜晶体;
b 在坩埚中充分灼烧;
c 在干燥器中冷却;
d 称量所得黑色固体质量;
e 重复 b~d 操作直至连续两次称量差值不超过 0.001g。
①若氯化铜晶体质量为 3.384g,最终得到黑色固体质量为 1.600g,则 x=______(精确到 0.1)。
②若加热时有固体溅出坩埚,则测得x 值______填“偏大”“不变”或“偏小”)。
-
碱式氯化铜[CuaClb(OH)c·xH2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。步骤1:将铜粉加入稀盐酸中,并持续通空气反应生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如下图所示。步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。

下列有关说法正确的是
A. a、b、c 之间的关系式为:a=b+c
B. 图中M、N分别为Fe2+、Fe3+
C. 步骤1充分反应后,加入少量CuO是为了除去Fe3+
D. 若制备1 mol的CuCl2,理论上消耗11.2 LO2
-
氯酸钾是常见的氧化剂,用于制造火药、烟火,工业上用石灰乳氯化法制备氯酸钾的流程如下所示:
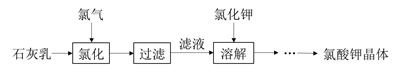
已知:氯化过程主要发生反应6Ca(OH)2 + 6Cl2 5CaCl2+Ca(ClO)2+6H2O
5CaCl2+Ca(ClO)2+6H2O
完成下列填空:
(1)工业生产氯气的方法是__________________。
(2)氯化过程需要控制较高温度,其目的有:
①_____________________________; ②减少 Cl2 与 Ca(OH)2 之间的副反应。
(3)向热的滤液中加入稍过量的氯化钾,待溶解完全后进行冷却,有大量氯酸钾晶体析出,写出相关反应的化学方程式:__________________________________________________。
得到的氯酸钾晶体中可能会含有少量氯化钾,进一步提纯的方法是_________________。
(4)为测定所得晶体中氯酸钾的纯度,将 a g 样品与 b g 二氧化锰混合,加热该混合物一段时间后(杂质不参加反应)冷却,称量剩余固体质量,重复加热、冷却、称量操作,记录数据如下表:
| 加热次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体质量(g) | c | d | e | e |
①进行加热操作时,应将固体置于_________(填仪器名称)中。
②该实验不必进行第五次加热的原因是_______________________________________。
③若某次测定结果的相对误差为-2.98%,写出导致这一结果的一种可能情况。
_______________________________________________________________
-
氯化亚铜是化工和印染等行业的重要原料,广泛用作有机合成的催化剂。
Ⅰ.甲采用CuCl2·2H2O热分解法制备CuCl,装置如图。
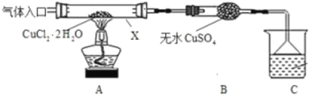
(1)仪器X的名称是_______________,C中烧杯的试剂可以是__________。
(2)“气体入口”通入的气体是_______。
(3)反应结束后,取所得产品分析,发现其中含有氧化铜,其可能原因是______________。
Ⅱ.乙另取纯净CuCl2固体用如下方法制备CuCl。

(4)操作②中反应的离子方程式为___________________。
(5)操作①中若用100 mL 10 mol/L盐酸代替0.2 mol/L盐酸,再通入SO2后,无白色沉淀产生。对此现象有如下两种猜想:
猜想一:c(H+)过大导致白色沉淀溶解。为验证此猜想,取75gCuCl2固体、100 mL0.2 mol/L盐酸及________mL10.0mol/LH2SO4配制成200 mL溶液,再进行操作②,观察是否有白色沉淀产生。
猜想二:_______________。请设计实验说明该猜想是否成立:_________________。
















