-
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)已知:2NO2(g)  N2O(g) △H1 2NO2(g)
N2O(g) △H1 2NO2(g)  N2O(l) △H2
N2O(l) △H2
下列能量变化示意图中,正确的是(选填字母) 。

(2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如下图)
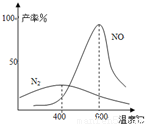
温度较低时以生成 为主,温度高于900℃时,NO产率下降的原因是 。
(3)火箭升空需要高能的燃料,经常是用四氧化二氮和联氨(N2H4)作为燃料,工业上利用氨气和氢气可以合成氨气,氨又可以进一步制备联氨等。
已知:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ•mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.0kJ•mol-1
NO2(g)  1/2 N2O4(g) △H=-26.35kJ•mol-1
1/2 N2O4(g) △H=-26.35kJ•mol-1
①写出气态联氨在气态四氧化二氮中燃烧生成氮气和水蒸气的热化学方程式: 。
②用氨和次氯酸钠按一定物质的量之比混合反应可生成联氨,该反应的化学方程式为 。
【答案】(1)A;(2)N2 ;氨气转化为一氧化氮的反应为放热反应;
(3)①2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-1083kJ/mol;②2NH3+NaClO=N2H4+NaCl+H2O。。
【解析】
2NO2(g)  N2O4(g) △H<0,由于同一物质在气体时含有的能量比液体或固体时多,所以A.可以正确的表示反应过程的能量变化,B、C不能正确的表示物质的能量与状态及反应过程的能量变化关系;(2)根据图示可知在低温时主要从事N2;温度高于900℃时,NO产率下降的原因是氨气转化为一氧化氮的反应为放热反应,根据平衡移动原理,升高温度,化学平衡向吸热的逆反应方向移动,所以NO的产率降低;(3)①已知:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ•mol-1 ① N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.0kJ•mol-1② NO2(g)
N2O4(g) △H<0,由于同一物质在气体时含有的能量比液体或固体时多,所以A.可以正确的表示反应过程的能量变化,B、C不能正确的表示物质的能量与状态及反应过程的能量变化关系;(2)根据图示可知在低温时主要从事N2;温度高于900℃时,NO产率下降的原因是氨气转化为一氧化氮的反应为放热反应,根据平衡移动原理,升高温度,化学平衡向吸热的逆反应方向移动,所以NO的产率降低;(3)①已知:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ•mol-1 ① N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.0kJ•mol-1② NO2(g)  1/2 N2O4(g) △H=-26.35kJ•mol-1③根据盖斯定律,②×2-①-③×2得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-1083kJ/mol;②氨和次氯酸钠反应时,氨气中的氮元素被氧化为N2H4,NaClO中的氯元素被还原为NaCl,根据电子守恒、原子守恒,可得该化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O。
1/2 N2O4(g) △H=-26.35kJ•mol-1③根据盖斯定律,②×2-①-③×2得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-1083kJ/mol;②氨和次氯酸钠反应时,氨气中的氮元素被氧化为N2H4,NaClO中的氯元素被还原为NaCl,根据电子守恒、原子守恒,可得该化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O。
考点:考查图像方法在热化学方程式的应用、热化学方程式和化学方程式的书写的知识。
【题型】填空题
【适用】较难
【标题】【百强校】2015-2016学年陕西西安高新一中高一下期末化学试卷(带解析)
【关键字标签】
【结束】
将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2  2SO3(正反应放热),反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热),反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是______。(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)求该反应达到平衡时SO2的转化率______(用百分数表示)。(写出计算过程)
(3)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?(写出计算过程)
-
(15分)氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛的应用。请回答下列问题:
(1)氨气可由N2和H2反应制取,N2(g)+3H2 (g)  2NH3(g)反应过程的能量变化如图所示:
2NH3(g)反应过程的能量变化如图所示:
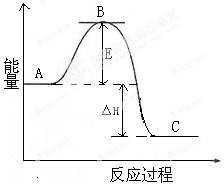
已知:1molN2分子中的化学键断裂时需要吸收942kJ的能量;1molH2分子中的化学键断裂时需要吸收436kJ的能量;形成1mol N—H键时释放390.8kJ的能量。
①图中A、C分别表示 ________、________,E的大小对该反应 的反应热有无影响?________。
该反应需要用铁触媒作催化剂,加铁触媒会使图中B点升高还是降低?________理由________。
②图中△H=________kJ·mol-1。
③如果反应速率ν(H2)为0.15mol· L-1 ·min-1,则ν(N2)=________mol· L-1 ·min-1 ν(NH3)=
________mol·L-1 ·min-1。
(2)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:N2(g)+2O2(g)=N2O4(l) △H= -19.5kJ·mol-1
N2H4(l)+O2(g)= N2(g)+2H2O(g) △H= -534.2kJ·mol-1
请写出肼和 N2O4反应的热化学反应方程式________。
-
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4 (1) △H1= -19.5kJ·mol-1
②N2H4 (1) + O2(g)= N2(g) + 2 H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2O4反应的热化学方程式 ;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。
-
(10分)氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 ;肼的结构式:
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4(l)反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4 (1) △H1= -195kJ·mol-1
② N2H4 (1) + O2(g)= N2(g) + 2 H2O(g) △H2= -534.2kJ·mol-1
写出N2H4 (1)和N2O4(1) 反应生成N2和水蒸气的热化学方程式 ;
(4)肼一空气燃料电池是一种具有高效,环境友好的碱性电池,,该电池放电时,负极的反应式为 。
-
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为________________。
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为____________________。
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)=N2O4(l)△H1=-19.5kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ·mol-1
写出肼和N2O4反应的热化学方程式________________________________________。
(4)肼-空气燃料电池是一种碱性电池,该电池放电时,正极的反应式为________________________________________。
-
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)写出氨气的电子式 。
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 。
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)===N2O4 (1) △H1=-19.5kJ·mol-1
②N2H4 (1)+ O2(g)===N2(g) + 2H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2O4 反应的热化学方程式 。
(4)肼一空气燃料电池是一种碱性电池,工作时释放出N2,该电池放电时,负极的反应式为 。
-
氮元素的氢化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮气的结构式为 ,氮的氢化物除了氨气,还有一种在常温下呈液态的肼,分子式为N2H4,请写出肼的电子式_________________;
(2)NH3与NaClO反应可得到肼,该反应的化学方程式为_____________________;
(3)肼在碱性环境下可以形成肼一空气燃料电池,肼被氧化为N2,该电池负极的反应式为____________,每生成56 g N2要消耗标准状况下的氧气的体积为____________L。
-
氢化钠(NaH)是一种还原性极强的物质,广泛应用于工业生产。
(1)氢化钠(NaH)中氢元素的化合价为 。
(2)NaH能与水剧烈反应:NaH+H2O= NaOH+H2↑,该反应中的氧化剂是 。如果有12gNaH与水反应,则转移电子的个数为 。
(3)在高温下氢化钠(NaH)可将四氯化钛(TiC14)还原成金属钛,该反应的化学方程式为 。
-
下图表示常见元素单质及化合物相应转化关系,部分反应的产物没有全部列出。
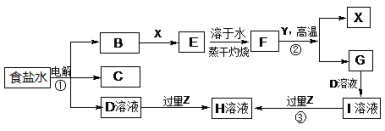
已知:B是一种黄绿色气体,C在所有气体中密度最小,D是一种碱;X、Y是生活中应用最为广泛的金属,F是一种红棕色氧化物,常用作红色油漆和涂料;Z为气态氧化物。
请回答下列问题:
(1)气体B具有 (填“还原性”、“氧化性”或“漂白性”),反应②属于四种基本反应类型反应中的 。
(2) 有学生认为B与X反应的产物E不一定是纯净物。他认为产物中可能还有 (填化学式),为验证其猜想该同学设计了相关实验,你认为他需要选择的试剂为 (填序号)。
a.酸性高锰酸钾溶液 b.NaOH溶液 c.KSCN溶液 d.稀硫酸
(3)若Z能导致温室效应,则反应③的离子反应方程式为 。
(4)若Z是我国酸雨形成的罪魁祸首,目前应用最广泛的工业处理含Z废气的方法是在一定条件下与生石灰作用而使其固定,产物可作建筑材料,反应的化学方程式为 。
(5)若Z是形成酸雨的另一种主要物质,Z与足量的D溶液反应时能被完全吸收,且生成两种盐(物质的量之比为1:1),请写出该反应的化学反应方程式 。
-
过氧化钙是重要的无机过氧化物。近年来,这种产品的用途,伴随着应用技术的开发在迅速增多,现已广泛用于化学工业和农业等方面的生产。工业上生产过氧化钙的主要流程如下:



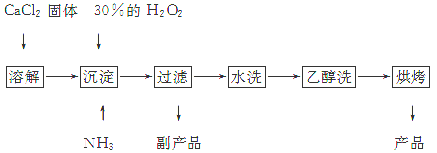
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是_________________________________;
(2)检验“水洗”是否合格的方法是__________________________________________;
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种):
①_______________________________________________________________________;②_______________________________________________________________________。
N2O(g) △H1 2NO2(g)
N2O(l) △H2

1/2 N2O4(g) △H=-26.35kJ•mol-1
N2O4(g) △H<0,由于同一物质在气体时含有的能量比液体或固体时多,所以A.可以正确的表示反应过程的能量变化,B、C不能正确的表示物质的能量与状态及反应过程的能量变化关系;(2)根据图示可知在低温时主要从事N2;温度高于900℃时,NO产率下降的原因是氨气转化为一氧化氮的反应为放热反应,根据平衡移动原理,升高温度,化学平衡向吸热的逆反应方向移动,所以NO的产率降低;(3)①已知:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ•mol-1 ① N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.0kJ•mol-1② NO2(g)
1/2 N2O4(g) △H=-26.35kJ•mol-1③根据盖斯定律,②×2-①-③×2得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-1083kJ/mol;②氨和次氯酸钠反应时,氨气中的氮元素被氧化为N2H4,NaClO中的氯元素被还原为NaCl,根据电子守恒、原子守恒,可得该化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O。
2SO3(正反应放热),反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)


