-
氨是最重要的化工产品之一。
(1)已知合成氨的反应是一个典型的可逆反应,在一个一定容积的密闭容器中加入1 mol 氮气和3mol 氢气,在一定条件下发生反应合成氨气,当反应物转化率达10%时,测得放出的热量为9.24kJ,请写出该条件下合成氨反应的热化学方式: 。
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g) [Cu(NH3)3]CH3COO·CO(l) ΔH<0
[Cu(NH3)3]CH3COO·CO(l) ΔH<0
吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是__________。(填字母)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) ΔH<0
CO(NH2)2(l)+H2O(g) ΔH<0
某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为__________。右图中的曲线表示该反应在前25s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其他条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线。
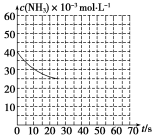
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 | H2CO3 | NH3·H2O |
| 电离平衡常数 | Ka1=4.30×10-7 | 1.77×10-5 |
| Ka2=5.61×10-11 |
现有常温下0.1mol·L-1的(NH4)2CO3溶液,
①你认为该溶液呈__________(填“酸”、“中”或“碱”性),原因是__________________。
②就该溶液中粒子之间有下列关系式,你认为其中不正确的是_________。
A.c(NH4+)>c(CO32-)>c(OH-)>c(H+)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol·L-1
D.c(NH4+)+c(NH3·H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
-
氨气是重要化工产品之一。传统的工业合成氨技术的反应原理是:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量浓度变化如图所示,回答下列问题:
2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量浓度变化如图所示,回答下列问题:
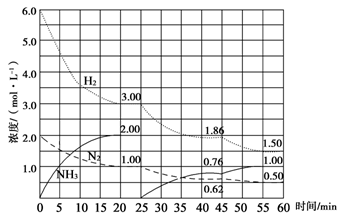
(1)计算反应在第一次平衡时的平衡常数K=________。(保留二位小数)
(2)产物NH3在5~10 min、25~30min和45~50 min时平均反应速率(平均反应速率分别以v1、v2、v3表示)从大到小排列次序为________。
(3)H2在三次平衡阶段的平衡转化率分别以α1、α2、α3表示,其中最小的是________。
(4)由第一次平衡到第二次平衡,平衡移动的方向是____________,采取的措施是____________
(5)请在下图中用实线表示25~60min 各阶段化学平衡常数K的变化图像。


-
氮的化合物在化工领域有重要的作用:
(1)以铁为催化剂, mol氮气和
mol氮气和 mol氢气在恒温、容积恒定为1 L的密闭容器中反应生成氨气,20 min后达到平衡,氮气的物质的量为
mol氢气在恒温、容积恒定为1 L的密闭容器中反应生成氨气,20 min后达到平衡,氮气的物质的量为 mol。
mol。
①该条件下氮气的转化率是______,该温度下  的化学平衡常数是______
的化学平衡常数是______ 保留小数点后两位
保留小数点后两位 。
。
②在第25 min时,保持温度不变,将容器体积迅速增大至2L并保持恒容,体系达到平衡时 的总转化率为
的总转化率为 氮气的转化率减小的原因是______。
氮气的转化率减小的原因是______。
③合成氨反应:
 ,在反应过程中只改变一个条件,正反应速率的变化如图所示:
,在反应过程中只改变一个条件,正反应速率的变化如图所示: 时改变的条件是______;
时改变的条件是______; 时改变的条件是______。
时改变的条件是______。

(2)① 是一种高能燃料,有强还原性,可通过
是一种高能燃料,有强还原性,可通过 和NaClO反应制得,写出该制备反应的化学方程式______。
和NaClO反应制得,写出该制备反应的化学方程式______。
②N2H4的水溶液呈弱碱性,室温下其电离常数 ,则
,则
 水溶液的pH等于______
水溶液的pH等于______ 忽略
忽略 的二级电离和
的二级电离和 的电离
的电离 。
。
③已知298K和101kPa条件下:




则 的燃烧热
的燃烧热 ______。
______。
-
(10分)硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。一定温度下,在密闭容器中充入ImolN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的 ,则N2的转化率
,则N2的转化率 ________;若容器压强恒定,达到平衡状态时,N=的转化率为
________;若容器压强恒定,达到平衡状态时,N=的转化率为 ,则
,则 ________
________ (‘填“>”、“<”或“=”)。
(‘填“>”、“<”或“=”)。
(2)用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2 4NO+6H2O 4NO+3O2+2H2O=4HNO3
4NO+6H2O 4NO+3O2+2H2O=4HNO3
现以3.4吨液氨为原料来生产质量分数为50%的硝酸,理论上需要加水的质量为________
吨。(假设生产过程中反应物和生成物均无损耗)
(3)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2,NO+NO2+Na2CO3=2NaNO2+CO2。若在标准状况下有NO、NO2的混合气体(不考虑N2O4)恰好与50mL 1. 0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
-
在一定条件下,由CO2与H2反应可合成甲醇,反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g);如图所示为向一固定容积为2 L的绝热密闭容器中加入1 mol CH3OH和1 mol H2O后,反应体系内CO2浓度的变化;其中第5 min 时,在其他条件不变的条件下,向容器中加入一定物质的量的 CO2和H2,第8 min 重新达到平衡状态,此时反应体系内c(H2)=c(CH3OH)。下列说法错误的是
CH3OH(g)+H2O(g);如图所示为向一固定容积为2 L的绝热密闭容器中加入1 mol CH3OH和1 mol H2O后,反应体系内CO2浓度的变化;其中第5 min 时,在其他条件不变的条件下,向容器中加入一定物质的量的 CO2和H2,第8 min 重新达到平衡状态,此时反应体系内c(H2)=c(CH3OH)。下列说法错误的是
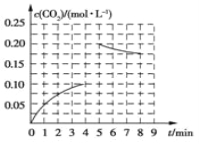
A. 0~4 min 内,生成CO2的平均反应速率为0.025 mol·L-1·min-1
B. 第5 min 时在反应容器中加入了0.20 mol CO2和0.40 mol H2
C. 8 min后CH3OH的平衡浓度为0.425 mol·L-1
D. 前5 min CH3OH的转化率为20%,5~8 min H2的转化率为37.5%
-
氢气是工业上重要的原料。
(1)氢气用于工业合成氨 N2(g) + 3H2(g)  2NH3(g);ΔH = -92.2 kJ·mol-1。
2NH3(g);ΔH = -92.2 kJ·mol-1。
① 一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t4 ﹑t5 ﹑t7时刻所对应的实验条件改变分别是
t4 ________t5 ________ t7________。
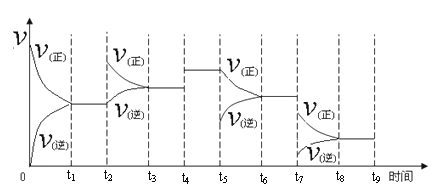
②温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪,此时放出热量46.1 kJ。则该温度下反应的平衡常数为________。
(2)工业上大量的氢气来源于焦炭与水蒸气高温下的反应:
C(s) + H2O(g)  H2(g) + CO(g) △H = +131.3 kJ/mol
H2(g) + CO(g) △H = +131.3 kJ/mol
①该反应在低温下不能自发进行的原因是________。
②恒温,在容积可变的密闭容器中,进行如上可逆反应。一段时间后,下列物理量不发生变化时,能表明该反应已达到平衡状态的有:Ⅰ混合气体的密度;Ⅱ容器内气体的压强;Ⅲ混合气体的总物质的量; ⅣCO物质的量浓度 ( )
A.只有Ⅳ B.只有Ⅰ和Ⅳ C.只有Ⅱ和Ⅲ
D.Ⅰ、Ⅲ和Ⅳ E.都可以
(3)在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入amol及bmol碘化氢(a>b)待反应:2HI(g) H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A________c(I2)B ;平衡时HI的分解率αA________αB ;平衡时H2在混合气体中的体积分数A________B (填写“>”“<”“=”)
H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A________c(I2)B ;平衡时HI的分解率αA________αB ;平衡时H2在混合气体中的体积分数A________B (填写“>”“<”“=”)
-
(11分)在一定温度下,向一个容积不变的密闭容器中加入 2 molA 和 2 molB ,发生反应:2A(g) + B(g) 3C( g) ΔH=-a kJ/mol(a>0),达到平衡时放出的热量为 bkJ,B的体积分数为ω1%。试回答:
(1)该反应平衡常数K表达式为________________________。 a与b的关系是ab(填“>”、“<”、“=”)。
(2)若升高温度,平衡常数K__________(填“增大”、“减小”或“不变”,下同),达到平衡时B的体积分数_________。
(3)下列说法中能表明该反应已达到平衡状态的是_________。
A.温度和体积一定时,容器内压强不再变化
B.温度和体积一定时,某一物质浓度不再变化
C.条件一定,混合气体的平均相对分子质量不再变化
D.温度和压强一定时,混合气体的密度不再变化
(4)若向上述平衡体系中再充入1 molB 和3 molC,在相同条件下达到平衡时B的体积分数为ω2 %,则ω1% ________ ω2 % (填“>”、“ =”或“<”),理由是。
-
已知CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)
现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制温度,进行反应,测得相关数据的关系如图所示.下列说法正确的是( )
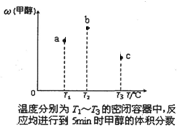
A.该反应的正反应的△H>0
B.反应进行到5min时,a容器中v正=v逆
C.减压可将b中的平衡状态转变成c中的平衡状态
D.达到平衡时,a、b、c中C0的转化率为b>a>c
-
已知CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)
 CH3OH(g)现在容积均为1L的a、b、c三个密闭容器中分别充入1mol C0和2mol H2的混合气体,控制温度,进行反应,测得相关数据的关系如图1和图2所示.下列说法中不正确的是( )
CH3OH(g)现在容积均为1L的a、b、c三个密闭容器中分别充入1mol C0和2mol H2的混合气体,控制温度,进行反应,测得相关数据的关系如图1和图2所示.下列说法中不正确的是( )

A.该反应的正反应的△H<0
B.反应进行到5min时,a容器中v(正)≠v(逆)
C.达到平衡时,a、b、c中CO的转化率为b>a>c
D.升温或减压,可将b中的平衡状态转变成c中的平衡状态
-
已知CO和H2在一定条件下合成甲醇的反应为CO(g)+2H2(g)  CH3OH(g)。现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是( )
CH3OH(g)。现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是( )

A.正反应的ΔH>0
B.反应进行到5 min时,b容器中v正=v逆
C.减压可将b中的平衡状态转变成c中的平衡状态
D.达到平衡时,a、b、c中CO的转化率为b>a>c
[Cu(NH3)3]CH3COO·CO(l) ΔH<0
CO(NH2)2(l)+H2O(g) ΔH<0







