-
氨催化分解既可防治氨气污染,又能得到氢能源,得到广泛研究。
(1)已知:
①4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H=-1266.6kJ·mol-1,
2N2(g)+6H2O(g) △H=-1266.6kJ·mol-1,
②H2(g)+1/2O2(g)===H2O(l) △H2=-285.8 kJ·mol-1
③H2O(l)===H2O(g) △H3=+44.0kJ·mol-1
反应①在任何温度下都能自发进行的原因为___________;NH3分解为N2和H2的热化学方程式______________________。
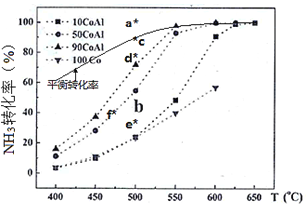
(2)在Co-Al催化剂体系中,压强P0下氨气以一定流速通过反应器,在相同时间下测转化率。得到不同催化剂下氨气转化率随温度变化曲线如下图。使反应的活化能最小的催化剂为___________。同一催化剂下,温度高时NH3的转化率接近平衡转化率的原因___________。如果增大氨气浓度(其它条件不变),则b点对应的点可能为___________。(填“a”、“c”或“d”)

(3)T℃时,体积为2L的密闭容器中加入1.0molNH3和0.2molH2,30min达到平衡时,N2体积分数为20%,则T℃时平衡常数K=___________,NH3转化率为___________;达到平衡后再加入1.0molNH3和0.2molH2,此时体系中v正___________v逆(填“>“<”或“=”)。
-
氨催化分解既可防治氨气污染,又能得到氢能源,得到广泛研究。
(1)已知:①反应I:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1,
2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1,
②H2的燃烧热ΔH2=-285.8 kJ.mol-1
③水的气化时ΔH3=+44.0 kJ.mol-1
反应I热力学趋势很大(平衡常数很大)的原因为______________________________;NH3分解的热化学方程式________________________________。
(2)在Co-Al催化剂体系中,压强P0下氨气以一定流速通过反应器,得到不同催化剂下氨气转化率随温度变化曲线如下图,活化能最小的催化剂为_______,温度高时NH3的转化率接近平衡转化率的原因_______________。如果增大气体流速,则b点对应的点可能为______(填“a”、“c”、“d”、“e”或“f”);
(3)温度为T时,体积为1L的密闭容器中加入0.8molNH3和0.1molH2,30min达到平衡时,N2体积分数为20%,则T时平衡常数K=______,NH3分解率为_____;达到平衡后再加入0.8molNH3和0.1molH2,NH3的转化率________(填“增大”、“不变”、“减小”)。
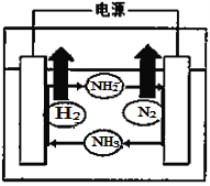
(4)以KNH2为电解质溶液电解NH3,其工作原理如下图所示,则阳极电极反应为_________。
-
氨催化分解既可防治氨气污染,又能得到氢能源。回答下列问题:
(1)已知:①4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)ΔH1=-1266.6kJ·mol-1
②H2(g)+ O2(g)=H2O(1)ΔH2=-285.8kJ·mol-1
O2(g)=H2O(1)ΔH2=-285.8kJ·mol-1
③H2O(1)=H2O(g)ΔH3=+44.0kJ·mol-1
反应①的热力学趋势很大(平衡常数很大),其原因是________________。NH3分解的热化学方程式为________________。
(2)在Co—Al催化剂体系中,压强p0下氨气以一定流速通过反应器,得到不同催化剂下NH3转化率随温度变化的关系如图所示。活化能最小的催化剂为________________:升高温度,NH3的平衡转化率增大,其原因是________________;温度一定时,如果增大气体流速,则b点对应的点可能________________(填“a”“c”“d”“e”或“f”)。
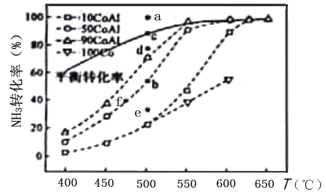
(3)温度为T时,体积为1L的密闭容器中加入0.8molNH3和0.1molH2,30min达到平衡时,N2的体积分数为20%,则T时反应2NH3(g)⇌N2(g)+3H2(g)的平衡常数K=________________mol2·L-2,NH3的分解率为________________,达到平衡后再加入0.8molNH3和0.1molH2,NH3的转化率________________(填“增大”“不变”或“减小”)。
(4)将氨溶解于水也可消除氨气的污染。常温下,向10mL0.1mol·L-1氨水中逐滴加入相同浓度的CH3COOH溶液,在滴加过程中 =________________(填标号).
=________________(填标号).
A.始终碱小B.始终增大C.先减小后增大D.先增大后减小
-
氮的氧化物是大气的主要污染物,是当前环保工作的重要研究内容之一。
(1)氨气还原氮的氧化物
①N2(g)+O2(g)=2NO(g) △H1 ②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=________。(用含△H1、△H2的式子表示)
依据反应②,可将氨气直接用于燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:____________。
(2)在一密闭容器中投入一定量的氨气,发生反应2NH3 N2+3H2△H>0,反应过程中NH3的浓度随时间变化的情况如图所示。
N2+3H2△H>0,反应过程中NH3的浓度随时间变化的情况如图所示。

请回答:
①曲线A中,反应在前2min内氢气的平均反应速率为________。此条件下的平衡常数K=____。
②在其它条件相同时,若改变某一条件,使该反应发生如图曲线B的反应情况,则此条件可能是改变_________(填“浓度”、“压强”、“温度”或“催化剂”)。简述判断理由_________。
(3)一定温度下,在恒压密闭容器中N2O5可发生下列反应:
①2N2O5(g) 4NO2(g)+O2(g) ②2NO2(g)
4NO2(g)+O2(g) ②2NO2(g) 2NO(g)+O2(g)
2NO(g)+O2(g)
若达平衡时,c(NO2)=0.6mol/L,c(O2)=1.2mol/L,则反应②中NO2的转化率为______,N2O5(g)的起始浓度应至少大于______mol/L.
-
氮的氧化物是大气的主要污染物,是当前环保工作的重要研究内容之一。
(1)氨气还原氮的氧化物
①N2(g)+O2(g)=2NO(g) △H1 ②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=________。(用含△H1、△H2的式子表示)
依据反应②,可将氨气直接用于燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:______________________________。

(2)一定温度下,向2L恒容密闭容器中充入4.0mol NO2和4.0mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g)  N2(g)+4CO2(g) △H<0,测得相关数据如下:
N2(g)+4CO2(g) △H<0,测得相关数据如下:
①0~5min,用NO2的浓度变化表示的反应速率为____。
②以下表述能说明该反应己达到平衡状态的是____。
A.气体颜色不再变化 B.气体密度不再变化 C.气体平均相对分子质量不再变化
③20 min时,保持温度不变,继续向该容器中加入l.0mol NO2和l.0molCO,在t1时反应再次达到平衡,则NO2的转化率比原平衡____(填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K= _____。
(3)湿法脱硝:采用NaClO2 溶液作为吸收剂可对烟气进行脱硝。323 K 下,向足量碱性NaClO2 溶液中通入含NO 的烟气,充分反应后,溶液中离子浓度的分析结果如下表:
| 离子 | NO3- | NO2- | Cl- |
| c/(mol • L-1) | 2.0×10-4 | 1.0×10-4 | 1.75×10-4 |
①NaClO2 溶液显碱性,用离子方程式解释原因_______________________。
②依据表中数据,写出NaClO2溶液脱硝过程中发生总反应的离子方程式____________。
-
含氮化合物是化工、能源、环保等领域的研究热点。回答下列问题:
(1)N2O在金粉表面发生热分解反应:2N2O(g) 2N2(g)+O2(g) ∆H
2N2(g)+O2(g) ∆H
己知:4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ∆H1
2NH3(g)+3N2O(g)=4N2(g)+3H2O(l) ∆H2
∆H=____(用含∆H1、∆H2的代数式表示)。
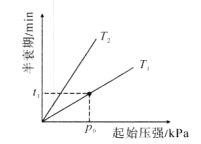
(2)一氧化二氮可反生2N2O(g) 2N2(g)+O2(g)。不同温度(T),N2O分解半哀期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___T2(填“>”、“=”或“<”)。当温度为T1、起始压强为P0,反应至t1min时,体系压强P=____(用P0表示)。
2N2(g)+O2(g)。不同温度(T),N2O分解半哀期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___T2(填“>”、“=”或“<”)。当温度为T1、起始压强为P0,反应至t1min时,体系压强P=____(用P0表示)。
(3)将NH3与O2按体积比4:5充入刚性容器中,起始体系总压强为P0kPa,分别在催化剂M、N作用下发生反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ∆H3=-905.0kJ/mol,NH3的分压(P)与时间和温度的关系如图所示:
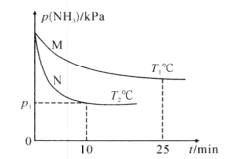
①催化剂的催化效果:M____N(填“强于”或“弱于”)。
②T°C时,0~12.5min内P(NH3)减小量___(填“>”、“=”或“<”)12.5~25min内P(NH3)减小量,理由为___。
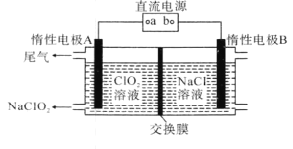
(4)NaClO2是一种绿色消毒剂和漂白剂,工业上采用电解法制备NaClO2的原理如图所示。
①交换膜应选用___(填“阳离子交换膜”或“阴离子交换膜”)。
②阳极的电极反应式为_____。
-
氨气及含氮化合物在化工生产和国防工业中具有广泛应用。请回答:
(1)已知:(i)氢气的燃烧热为286.0 kJ• mol-1
(ii)4NH3(g)+3O2(g) 2N2(g)+6H2O △H=-1530.6kJ•mol-1。
2N2(g)+6H2O △H=-1530.6kJ•mol-1。
①合成氨反应的热化学方程式为__________________________________。
②对于反应(ii),正、逆反应活化能的大小关系为:E正_______E逆 (填>、=或<)。
(2)恒温恒容条件下,起始按物质的量之比为1 : 1向密闭容器中充入N2(g)和H2(g),发生合成氨的反应。达平衡后,N2(g)的体积分数为_________;然后只降低温度,N2(g)的体积分数会______(填选项字母)。
A.增大 B.减小 C.不变 D.不能判断
(3)T℃ 时,CO2(g)和 NH3(g)合成尿素的原理为 2NH3(g)+ CO2(g) CO(NH2)2(s)+H2O(l)。在2 L恒容密闭容器中,通入1.2 mol NH3(g)和0.6 mol CO2(g),2 min时反应恰好达到平衡,测得c(NH3)=0.2mol • L-1
CO(NH2)2(s)+H2O(l)。在2 L恒容密闭容器中,通入1.2 mol NH3(g)和0.6 mol CO2(g),2 min时反应恰好达到平衡,测得c(NH3)=0.2mol • L-1
①0-2 min内,用NH3表示的反应速率v(NH3)=___________;反应的平衡常数K=__________。
②若其他条件不变,2 min时将容器体积迅速压缩到1 L,在3 min时重新达到平衡,请在图1中画出2〜3 min内c(NH3)随时间(t)变化的曲线关系图:__________。
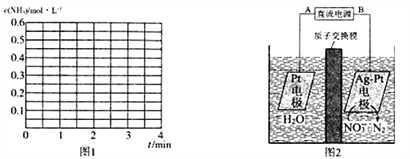
(4)电化学降解法可用于治理水中硝酸盐的污染,电化学降解NO3-的原理如图2所示:
①电源正极为___________(填“A”或“B”),阴极反应式为________________________________。
②若电解过程中转移了 1 mol e-,则膜两侧电解液的质量变化差值(Δm正-Δm右)为________g。
-
氨气及含氮化合物在化工生产和国防工业中具有广泛应用。请回答:
(1)已知:(i)氢气的燃烧热为286.0 kJ·mol-1
(ii)4NH3(g)+3O2(g) 2N2(g)+6H2O (l) ΔH=- 1530.6 kJ·mol-1。
2N2(g)+6H2O (l) ΔH=- 1530.6 kJ·mol-1。
合成氨反应的热化学方程式为_____________________________。
(2)恒温恒容条件下,起始按物质的量之比为1∶1向密闭容器中充入N2(g)和H2(g),发生合成氨的反应。达平衡后,N2(g)的体积分数为_______________;然后只降低温度,N2(g)的体积分数会_________(填选项字母)。
A.增大 B.减小 C.不变 D.不能判断
(3)T℃时,CO2(g)和NH3(g)合成尿素的原理为2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(1)。在2 L恒容密闭容器中,通入1.2 mol NH3(g)和0.6 mol CO2(g),2 min时反应恰好达到平衡,测得c(NH3)=0.2 mol·L-1。
CO(NH2)2(s)+H2O(1)。在2 L恒容密闭容器中,通入1.2 mol NH3(g)和0.6 mol CO2(g),2 min时反应恰好达到平衡,测得c(NH3)=0.2 mol·L-1。
①0~2min内,用NH3表示的反应速率υ(NH3)=___________;反应的平衡常数K=____________。
②若其他条件不变,2 min时将容器体积迅速压缩到1L,在3 min时重新达到平衡,请在图1中画出2~3 min内c(NH3)随时间(t)变化的曲线关系图。
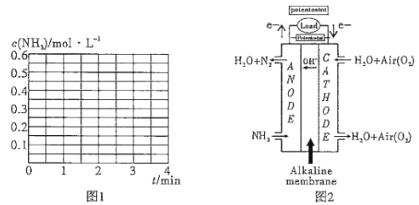
(4)碱性氨气燃料电池的装置如图2 所示,写出负极的电极反应式____________________。当电路中每通过3.6 mol e-,则需要标况下空气的体积________________L。
-
利用氨气脱硝 除
除 是大气污染防治研究的热点,脱硝过程中涉及的反应为:
是大气污染防治研究的热点,脱硝过程中涉及的反应为:
主反应:
副反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905.5KJ/mol
②4NH3(g)+4O2(g)=2N2O(g)+6H2O(g) △H=-1104.9KJ/mol
③4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1269.0KJ/mol
回答下列问题:
(1)主反应的△H为______
(2)如图所示,保持其它条件相同,使用两种不同的催化剂,主反应NO的转化率与温度关系如图所示:
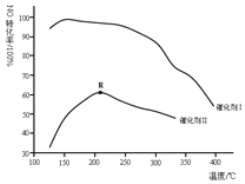
①选用催化剂I的优势有______ 写出一点
写出一点
②R点对应的温度为2100C,低于2100C,NO的转化率是不是对应温度下的平衡转化率,请作出判断并写出理由______.
(3)常温下,在通入氧气的条件下用 的NaOH溶液吸收NO也可实现脱硝
的NaOH溶液吸收NO也可实现脱硝 产物主要为
产物主要为 和
和 ,已知反应后溶液的
,已知反应后溶液的 ,溶液中
,溶液中 浓度为5.6×10-2mol/L,忽略反应过程中溶液体积变化,
浓度为5.6×10-2mol/L,忽略反应过程中溶液体积变化, 的电离平衡常数为5.1×10-4,则:
的电离平衡常数为5.1×10-4,则:
①c(NO2-)c(OH-)/c(HNO2)=______
②某溶液中c(NO2-)=1.0×10-6mol/L,取该溶液5mL,加入一滴 的硝酸银溶液
的硝酸银溶液 一滴为
一滴为 ,通过计算说明能否产生沉淀______[Ksp(AgNO2)=2×10-8]
,通过计算说明能否产生沉淀______[Ksp(AgNO2)=2×10-8]
-
科学家一直致力于“人工固氮”的新方法研究。
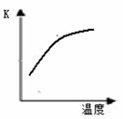
(1)最新“人工固氮”的研究报道:常温常压.光照条件下,N2在催化剂表面与水发生反应:2N2 (g)+6H2O (l)  4NH3 (g)+3O2 (g)+ Q
4NH3 (g)+3O2 (g)+ Q
已知该反应的平衡常数K与温度的关系如右图,则此反应的 Q 0 (填“>”“<”或“=”)。
(2)常温下,如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,________ (选填编号)。
A.容器中气体的平均分子量不随时间而变化 B.v(N2)/ v(O2)=2:3
C.容器中气体的密度不随时间而变化 D.通入稀有气体能提高反应的速率
(3)将反应生成的混合气体通入水中即可得氨水。用水稀释0.1mol·L-1氨水,溶液中随着水量的增加而增大的是 (填字母标号)。
A.c(H+)×c(NH3·H2O)/c(OH-) B.c(NH4+)×c(OH-)/c(NH3·H2O)
C.c(H+)·c(OH-) D.
(4)常温下,在恒压密闭容器中上述反应达到平衡后,在其他条件不变时,通入2mol N2,请在右图中画出正(v正).逆(v逆)反应速率随时间t变化的示意图。
2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1,












