-
I.在容器为1L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),且温度升高,混合气体的颜色加深。100℃时,体系中各物质的浓度随时间的变化如图15所示。回答下列问题:
2NO2(g),且温度升高,混合气体的颜色加深。100℃时,体系中各物质的浓度随时间的变化如图15所示。回答下列问题:
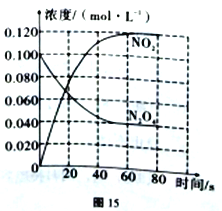
(1)100℃时,在0~60s时段,反应速率v(N2O4)为______mol/(L·s),反应的平衡常数K为_______。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol/(L·s)平均速率降低,经10s又达到平衡.T_____100℃(填“大于”或“小于”),判断理由是_________。
II.利用LiOH和钴氧化物可制备锂离子电池。正极材料LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
(1)利用如图16所示的装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为_____溶液(填化学式),阳极电极反应式为__________________。
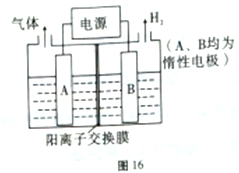
(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钻氧化物的艺流程如图17:

Co(OH)3在酸溶并发生氧化还原反应时的离子方程式为______________________。在空气中煅烧CoC2O4生成钴的氧化物和CO2,测得充分煅烧后固体的质量为2.73g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为_____________。
-
将NO2装入带活塞的密闭容器中,当反应2NO2(g) N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是
A.升高温度,气体颜色加深,则此反应为吸热反应
B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅
C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D.恒温恒容时,充入惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅
-
将NO2装入带活塞的密闭容器中,当反应2NO2(g) N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是
A.升高温度,气体颜色加深,则此反应为吸热反应
B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅
C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D.恒温恒容时,充入惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅
-
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
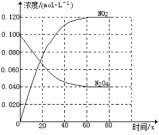
(1)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。T___100℃(填“大于”“小于”),判断理由是___。
(2)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___(填“正反应”或“逆反应”)方向移动,判断理由是___。
-
(10分)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g) △H,随温度升高,混合气体的颜色变深。
2NO2(g) △H,随温度升高,混合气体的颜色变深。

回答下列问题:
(1)反应的△H 0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,平均反应速率v(NO2)为 mol·L-1·s-1,反应的平衡常数K为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4) 以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。则T 100℃(填“大于”或“小于”)。
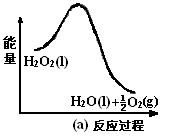
(3)利用图(a)和(b)中的信息,按图(b)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是_____________。

-
(13分)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
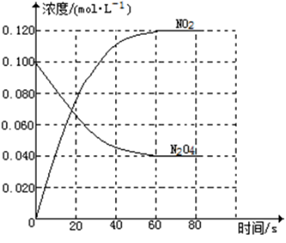
回答下列问题:
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 mol·L-1·s-1反应的平衡常数K1为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),判断理由是 。
②列式计算温度T是反应的平衡常数K2
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
-
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
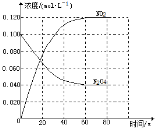
回答下列问题:
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 mol·L-1·s-1反应的平衡常数K1为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。a:T 100℃(填“大于”“小于”),判断理由是 。
b:列式计算温度T是反应的平衡常数K2
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
-
在一定温度下,容积固定的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)  2NO2(g),体系中各物质浓度随时间变化如图所示,则下列叙述错误的是
2NO2(g),体系中各物质浓度随时间变化如图所示,则下列叙述错误的是
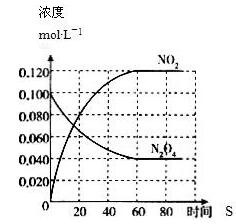
A. 若温度升高,混合气体的颜色变深
B. 在该温度下反应2NO2(g)  N2O4(g)的平衡常K为25/9
N2O4(g)的平衡常K为25/9
C. 反应达平衡后,将反应容器的容积减少一半,平衡向正反应方向移动
D. 反应达平衡后,向此容器中通入NO2气体,则c(NO2)增大
-
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
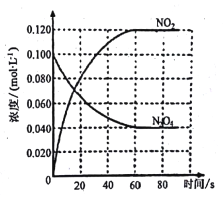
回答下列问题:
(1)反应的△H_______0(填“大于”或“小于”) ;100℃时,体系中各物质浓度随时间变化如上图所示。在0-60s时段,反应速率v(N2O4)为______mol·L-1·s-1;反应的平衡常数K1为________。
(2) 100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。
a: T______100℃ (填“大于”或“小于”) ,判断理是_______
b:计算温度T时反应的平衡常数K2(要求写出计算过程)__________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向______(填“正反应”或“逆反应”)方向移动,判断理由是__________
-
在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。

回答下列问题:
(1)反应的ΔH____0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60 s时段,反应速率v(N2O4)为____mol·L-1·s-1;反应的平衡常数K1为________。
(2)100℃时达平衡后,改变反应温度为T,经10 s又达到平衡,且c (N2O4)为0.01 mol·L-1。
① T___100℃(填“大于”或“小于”),判断理由是_______________。
② 计算温度T时反应的平衡常数K2 ______。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向______(填“正反应”或“逆反应”)方向移动,判断理由是___________________。
2NO2(g),且温度升高,混合气体的颜色加深。100℃时,体系中各物质的浓度随时间的变化如图15所示。回答下列问题:











