-
某同学探究NaHCO3的性质,部分实验报吿记录如下:
① 常温下,配制0.10 moI/L NaHCO3溶液,测其pH为8.4;
② 取少量该溶液于试管中,向其中滴加CaCl2溶液至中性,滴加过程中只产生一种白色沉淀(能与盐酸作用产生气体),但无气体放出。
下列说法不正确的是
A. NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度
B. 加入CaCl2促进了HCO3-的水解
C. 反应的离子方程式是2HCO3-+Ca2+=CaCO3↓+ H2CO3
D. 反应后的溶液中存在:c(Na+)+ 2c(Ca2+)=c(HCO3-)+2c(CO32-) +c(Cl-)、
高三化学选择题困难题查看答案及解析
-
某同学在实验室探究NaHCO3的性质:常温下,配制0.10 mol/ L NaHCO3溶液,测其pH为8.4;取少量该溶液滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出。下列说法不正确的是( )
A. NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度
B. 反应的过程中产生的白色沉淀为CaCO3
C. 反应后的溶液中存在:c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-)
D. 加入CaCl2促进了HCO3-的水解
高三化学单选题中等难度题查看答案及解析
-
某同学在实验室探究NaHCO3的性质:常温下,配制0.10mol·L-1 NaHCO3溶液,测其pH为8.4;取少量该溶液滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出。下列说法不正确的是
A.NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度
B.加入CaCl2促进了HCO3-的水解
C.反应的离子方程式是2HCO3-+Ca2+==CaCO3↓+H2CO3
D.反应后的溶液中存在:c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-)
高三化学选择题困难题查看答案及解析
-
某同学在实验室探究NaHCO3的性质:常温下,配制0.10mol/LNaHCO3溶液,测其pH为8.4;取少量该溶液滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出。下列说法不正确的是
A.NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度
B.加入CaCl2促进了HCO3-的水解
C.反应的离子方程式是2HCO3-+Ca2+==CaCO3↓+H2CO3
D.反应后的溶液中存在:c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-)
高三化学选择题困难题查看答案及解析
-
某同学在实验室探究 NaHCO3的性质:常温下,配制0..10 mol·L -1NaHCO3溶液,测其pH为8.4;取少量该溶液滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出。下列说法不正确的是
A. NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度
B. 反应的离子方程式是2HCO3-+Ca2+=CaCO3↓+H2CO3
C. 加入CaCl2促进了HCO3-的水解
D. 反应后的溶液中存在:c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-)
高三化学单选题中等难度题查看答案及解析
-
SO2虽是大气污染物之一,但也是重要的工业原料,某同学在实验室设计如下实验,对SO2的部分性质进行了探究。
(1)二氧化硫的水溶液
①SO2易溶于水,常温常压下溶解度为1:40,其中有H2SO3生成。向SO2的饱和溶液中加入NaHSO3固体,有气体冒出,原因是__________。(结合有关平衡方程式简要说明)
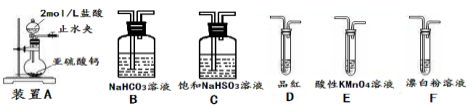
②欲验证酸性:H2SO3>HClO,选用下面的装置,其连接顺序为:
A
________(按气流方向用大写字母表示即可)。能证明H2SO3的酸性强于HClO的实验现象为___。
(2)二氧化硫的还原性
已知SO2具有还原性,可以还原I2,可以与Na2O2发生反应,按图示装置进行实验。(部分固定装置未画出)
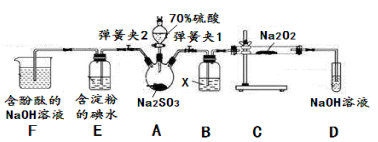
操作步骤
实验现象
解释原因
关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体
若将带火星的木条放在D试管口处,木条不复燃
SO2与Na2O2反应无O2生成,可能发生的化学反应方程式为①____
若将带火星的木条放在D试管口处,木条复燃
SO2与Na2O2反应有O2生成,发生的化学反应为:2SO2+2Na2O2=2Na2SO3+O2
关闭弹簧夹1,打开弹簧夹2,残余气体进入E,F中。
E中②__________
E中反应的离子方程式③________
F中④__________
F中反应为2OH-+SO2=SO32-+H2O
高三化学简答题困难题查看答案及解析
-
某学习小组学习了亚铁盐的性质后,欲探究FeSO4溶液分别与Na2CO3溶液、NaHCO3溶液的反应。已知:Fe(OH)2和FeCO3均为白色沉淀,不存在Fe(HCO3)2。实验操作及现象记录如下:
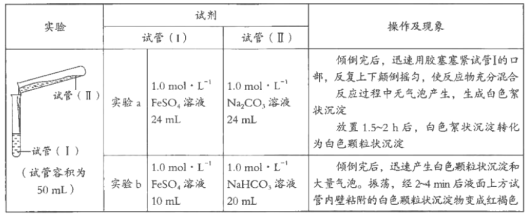
(1)甲同学认为实验a中白色颗粒状沉淀是FeCO3,写出该反应的离子方程式:_________________________;他为了证实自己的观点,进行实验:取少量白色颗粒状沉淀,加入__________,发现产生大量气泡。
(2)乙同学推测实验a的白色颗粒状沉淀中还可能含有Fe(OH)2,他将实验a中两种溶液体积均改为15mL后再进行实验,证实了他的推测。能证明Fe(OH)2存在的实验现象是___________________________。
(3)实验b中白色颗粒状沉淀主要成分也为FeCO3,写出生成FeCO3的离子方程式:_____________________________。
(4)实验b中液面上方试管内壁粘附的白色颗粒状沉淀物变为红褐色,主要原因是潮湿的FeCO3被氧气氧化,写出该反应的化学方程式:_________________。
(5)乙同学反思,实验a中含有Fe(OH)2,实验b中几乎不含有Fe(OH)2,对比分析出现差异的原因是_____________________________。
高三化学实验题中等难度题查看答案及解析
-
某学习小组学习了亚铁盐的性质后,欲探究FeSO4溶液分别与Na2CO3溶液、NaHCO3溶液的反应。已知:Fe(OH)2和FeCO3均为白色沉淀,不存在Fe(HCO3)2。实验操作及现象记录如下:
实验
试剂
操作及现象
试管(I)
试管(II)
(试管容积为50 mL)
实验a
1.0 mol·L-1
FeSO4溶液
24 mL
1.0 mol·L-1
Na2CO3溶液24mL
倾倒完后,迅速用胶塞塞紧试管I的口部,反复上下颠倒摇匀,使反应物充分混合
反应过程中无气泡产生,生成白色絮状沉淀
放置1.5~2 h后,白色絮状沉淀转化为白色颗粒状沉淀
实验b
1.0 mol·L-1
FeSO4溶液 10 mL
1.0 mol·L-1 NaHCO3溶液 20 mL
倾倒完后,迅速产生白色颗粒状沉淀和大量气泡。振荡,经2~4 min后液面上方试管内壁粘附的白色颗粒状沉淀物变成红褐色
(1)甲同学认为实验a中白色颗粒状沉淀是FeCO3,写出该反应的离子方程式:________;他为了证实自己的观点,进行实验:取少量白色颗粒状沉淀,加入________,发现产生大量气泡。
(2)乙同学推测实验a的白色颗粒状沉淀中还可能含有Fe(OH)2,他将实验a中两种溶液体积均改成15 mL后再进行实验,证实了他的推测。能证明Fe(OH)2存在的实验现象是_________。
(3)实验b中白色颗粒状沉淀主要成分也为FeCO3,写出生成FeCO3的离子方程式:________。
(4)实验b中液面上方试管内壁粘附的白色颗粒状沉淀物变成红褐色,主要原因是潮湿的FeCO3被氧气氧化,写出该反应的化学方程式:__________。
(5)乙同学反思,实验a中含有Fe(OH)2,实验b中几乎不含有Fe(OH)2,对比分析出现差异的原因是_________。
高三化学实验题困难题查看答案及解析
-
常温下,将一定浓度的HA和HB分别与0.10mol/L的NaOH溶液等体积混合,实验记录如下表:
实验编号
加入的酸
加入酸的浓度/(mol/L)
混合后溶液的pH
①
HA
0.10
8.7
②
HB
0.12
2
下列说法中正确的是
A. HA是强酸,HB是弱酸
B. 升高温度,溶液②中c(B-)/c(Na+)增大
C. 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH->c(H+)
D. 溶液②中离子浓度的关系:c(Na+)+c(H++c(B-)=0.12 mol/L
高三化学选择题中等难度题查看答案及解析
-
常温下,用0.10 moI/LNaOH溶液滴定0.10 mol/LHA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示。下列叙述错误的是
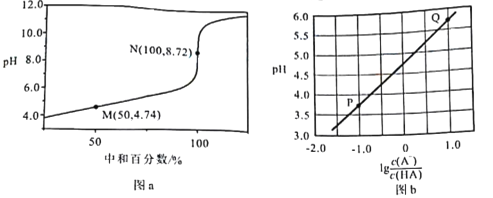
A. Ka(HA)的数量级为10-5
B. N点,
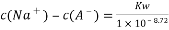
C. P—Q过程中,水的电离程度逐渐增大
D. 当滴定至溶液呈中性时,c(A-)>c(HA)
高三化学单选题中等难度题查看答案及解析