-
硼(B)可形成H3BO3、NaBH4、NaBO2等化合物,用途广泛。
(1)H3BO3为一元弱酸,常温下,在水中存在如下电离平衡:H3BO3 + H2O [B(OH)4]-+H+,Ka=5.72×10-10。
[B(OH)4]-+H+,Ka=5.72×10-10。
①25℃时,0.175 mol/L的H3BO3溶液pH约为_________。
②已知碳酸H2CO3的电离平衡常数为Ka1 = 4.4×10-7,Ka2 = 4.7×10-11。将少量碳酸钠溶液滴加到饱和硼酸溶液中,反应的离子方程式为_________。
(2)在容积恒定为2 L的密闭容器中加入足量BPO4和Na固体并充入一定量的H2(g)发生储氢反应:BPO4(s)+4Na(s)+2H2(g) Na3PO4(s)+NaBH4(s) △H<0
Na3PO4(s)+NaBH4(s) △H<0
①体系中H2的物质的量与反应时间的关系如表所示:
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n(H2)/mol | 2.0 | 1.5 | 1.2 | 0.9 | 0.8 | 0.8 |
下列有关叙述正确的是(填标号)_________。
a. 当容器内气体的摩尔质量不再变化时,反应达到平衡状态
b. 10 min时向容器内通入少量H2,则重新达平衡前ν(放氢)> ν(吸氢)
c. 保持温度不变,平衡后再充入1 mol H2,达新平衡时H2的浓度为0.4 mol/L
d. 升高温度,放氢速率加快,重新达到平衡时容器压强增大
②图为产率与反应温度的关系曲线,NaBH4的产率在603K之前随温度升高而增大,在603K之后随温度升高而减小的原因是_________。
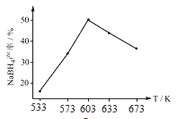
(3)NaBH4(s)遇H2O(l)剧烈水解,生成氢气和NaBO2(s)。
①通常状况下,实验测得3.8 g NaBH4(s)发生水解反应放出21.6 kJ热量,写出该反应的热化学方程式_________。
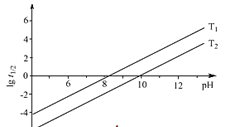
② 为NaBH4水解的半衰期(水解一半所需要的时间,单位为min)。lg
为NaBH4水解的半衰期(水解一半所需要的时间,单位为min)。lg 随pH和温度的变化如图所示。溶液pH=4时,NaBH4_________(填“能”或“不能”)稳定存在,原因是_________(用离子方程式表示);T1_________T2。(填 “>”或“<”)
随pH和温度的变化如图所示。溶液pH=4时,NaBH4_________(填“能”或“不能”)稳定存在,原因是_________(用离子方程式表示);T1_________T2。(填 “>”或“<”)
③硼氢化钠具有极强还原性,碱性条件可用于处理电镀废液中的CuSO4制得纳米铜,从而变废为宝。写出电镀阳极反应方程式_______________。
-
硼(B)可形成 H3BO3、NaBH4 、NaBO2等化合物,用途广泛。
(1)H3BO3 为一元弱酸,可由硼砂(Na2B4O7﹒10H2O)与盐酸加热反应制得。该反应的化学方程式为____________________。 常温下 0.1 mol·L-1的H3BO3溶液 pH 约为5.0,则H3BO3的电离常数Ka约为____。
(2)在恒容密闭容器中发生储氢反应:BPO4(s)+4Na(s)+ 2H2(g) Na3PO4(s) + NaBH4(s) ΛH<0
Na3PO4(s) + NaBH4(s) ΛH<0
下图为NaBH4产率与反应温度的关系曲线:
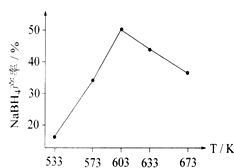
①反应达到平衡时,下列有关叙述正确的是_____。(填标号)
A.生成1mol NaBH4只需1mol BPO4、4mol Na和2 mol H2
B.若向容器内通入少量H2,则v(放氢)< v(吸氢)
C.升高温度,放氢速率加快,重新达到平衡时容器压强增大
D.降低温度,该反应的平衡常数减小
②NaBH4的产率在 603K之前随温度升高而增大的原因是___________________。
(3)NaBH4可水解放出氢气,反应方程式为:NaBH4 + 2H2O=NaBO2 + 4H2↑。
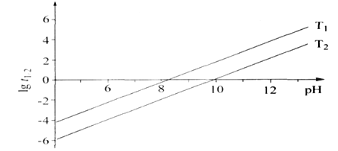
① t1/2为NaBH4水解的半衰期(水解一半所需要的时间,单位为分钟)。lgt1/2随 pH和温度的变化如图所示。在酸性条件下,NaBH4不能稳定存在,原因是_____(用离子方程式表示);T1__T2。(填“ >” 或“ <”)
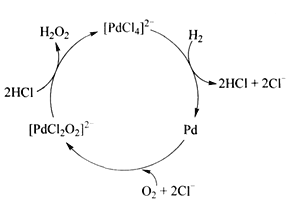
②用H2制备H2O2的一种工艺简单、能耗低的方法, 反应原理如下图所示。总反应的化学方程式为___________。
-
硼氢化钠(NaBH4)是常用的还原剂,用途广泛。某探究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:
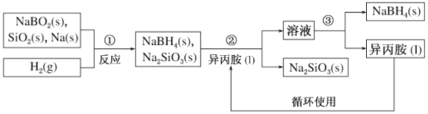
已知:NaBH4常温下易与水反应,可溶于异丙胺(沸点:33℃)
(1)在第①步反应加料之前,需要将反应器加热至 100 ℃以上并通入氩气 ,该操作的目的是______;第②步分离采用的方法是______;第③步分离NaBH4并回收溶剂,采用的方法是_____;
(2)NaBH4与水反应生成H2 : NaBH4 + 2H2O=NaBO2+4H2↑ (已知:HBO2是弱酸)。 实验测得,NaBH4每消耗一半所用的时间与溶液 pH、温度的关系如下表:
| pH | 8 | 10 | 12 | 1 4 |
| 温度/℃ | 25 | 25 | 25 | 25 |
| 时间/ min | 6. 2 ×10-1 | 6. 2 ×10 | 6. 2 ×103 | 6. 2 ×105 |
①NaBH4与水反应开始释放H2很快 ,经过一段时间后就缓慢下来 ,可能原因一是反应物浓度降低 ;二是________;
②为了加快制取的H2速率,常将一些促进剂投入水中,下列物质中可作为促进剂的是__;
a. 碳酸钾 b. 稀硝酸 c 硫酸氢钠 d. 氨水
(3)利用如图所示装置,可以测定NaBH4与水反应生成 H2的速率,在pH =10、25℃条件下,将恒压滴液漏斗中NaBH4滴加到含有催化剂的三颈烧瓶中。
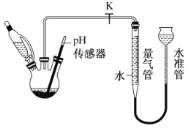
①实验中使用恒压滴液漏斗的原因为_________;
②气体生成结束后,水准管中的液面会高于量气管中的液面,此时量气管读数会_____( 填“偏大”或“偏小”)需要将水准管慢慢向下移动,则量气管中的液面会__________(填“上升”或“下降”);
③在此条件下,0. 38 g NaBH4开始反应至剩余 0. 19 g 时,实验测得量气管内气体体积为124mL,则这段时间内,生成H2的平均速率是_______mL·min-1。
-
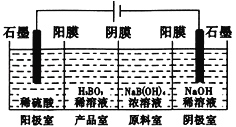
硼酸(H3BO3)为一元弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为:H3BO3+OH- = B(OH)4-,H3BO3可以通过电解的方法制备。其工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法正确的是

A. 电子流向: 电源负极→b电极→电解液→a 电极→电源正极
B. 阳极的电极反应式为:2H2O - 4e- = O2↑+4H+
C. 当电路中通过3mol电子时,可得到1mol H3BO3
D. A膜为阳膜,B膜为阴膜,且穿过A膜和B膜的离子数相同
-
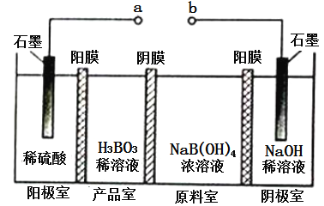
硼酸(H3BO3)为一元弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,H3BO3可以通过电解的方法制备。其工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法错误的是( )
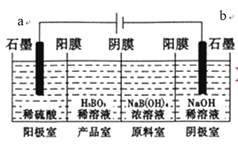
A. a与电源的正极相连接
B. 阳极的电极反应式为:2H2O-4e-=O2↑+4H+
C. 当电路中通过3mol电子时,可得到1molH3BO3
D. B(OH)4-穿过阴膜进入产品室,Na+穿过阳膜进入阴极室
-
硼酸(H3BO3)为一元弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为:H3BO3+OH-=B(OH)4一,H3BO3可以通过电解的方法制备。其工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法正确的是
A. 当电路中通过1mol电子时,可得到lmolH3BO3
B. 将电源的正负极反接,工作原理不变
C. 阴极室的电极反应式为:2H2O-4e-=O2+4H+
D. B(OH)4一穿过阴膜进入阴极室,Na+穿过阳膜进入产品室
-
硼酸(H3BO3) 为一元弱酸,H3BO3可以通过电解的方法制备。其工作原理如下图所示( 阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法错误的是
A. a 与电源的正极相连接
B. 阳极的电极反应式为:2H2O-4e-=O2↑+4H+
C. [B(OH)4]-穿过阴膜进入产品室,Na+穿过阳膜进入阴极室
D. 当电路中通过3mol 电子时,可得到1molH3BO3
-
NaBH4容易与H+反应产生氢气而成为储氢材料研究的热点。以硼酸为原料制备NaBH4的一种工艺流程如下图所示:
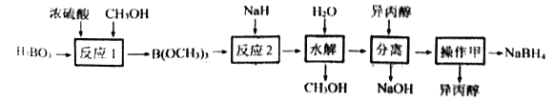
已知: ①H3BO3电离:H3BO3+H2O [B(OH)4]-+H+
[B(OH)4]-+H+
②反应1: H3BO3+3CH3OH B(OCH3)3+3H2O
B(OCH3)3+3H2O
③反应2:B(OCH3)3+4NaH= NaBH4+ 3CH3ONa
(1)H3BO3是____元酸,NaH的电子式为_______________。
(2)NaBH4与水剧烈反应放出H2。反应的化学方程式为________________。
(3)反应1属于______(填有机反应类型),反应过程中蒸出B(OCH3)3的目的是__________。
(4)“水解”时产生的大量NaOH,减缓了NaBH4与水的反应。在该步骤中,与水反应生成大量NaOH的物质是_________。
(5)“分离”后得到NaBH4的异丙醇溶液。操作甲是_____________。
(6)上述流程中可以循环使用的物质是____________。
(7)以惰性电极电解Na[B(OH)4]与NaOH 混合溶液也能制得NaBH4。阴极的电极反应式为___。
-
硼酸( H3BO3) 为一元弱酸,H3BO3可以通过电解的方法制备。其工作原理如右图所示( 阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法错误的是
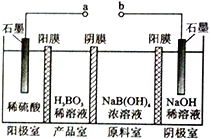
A. a 与电源的正极相连接
B. 阳极的电极反应式为:2H2O-4e-=O2↑+4H+
C. [B(OH)4]-穿过阴膜进入产品室,Na+穿过阳膜进入阴极室
D. 当电路中通过3mol 电子时,可得到1molH3BO3
-
(14分)硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4,其流程如下:
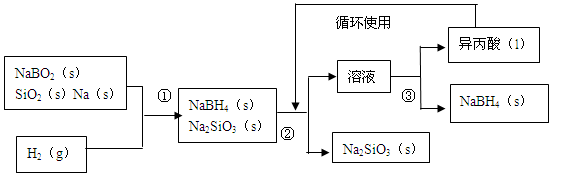
已知:NaBH4常温下能与水反应,可溶于异丙酸(沸点:13℃)。
(1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是_____,原料中的金属钠通常保存在____中,实验室取用少量金属钠需要用到的实验用品有_____,_____,玻璃片和小刀等。
(2)请配平第①步反应的化学方程式:
□NaBO2+□SiO2+□Na+□H2==□NaBH4+□Na2SiO3
(3)第②步分离采用的方法是______;第③步分离(NaBH4)并回收溶剂,采用的方法是______。
(4)NaBH4(s)与水(l)反应生成NaBO2(s)和氢气(g),在25℃,101KPa下,已知每消耗3.8克NaBH4(s)放热21.6KJ,该反应的热化学方程式是_______。

[B(OH)4]-+H+,Ka=5.72×10-10。
Na3PO4(s)+NaBH4(s) △H<0


为NaBH4水解的半衰期(水解一半所需要的时间,单位为min)。lg
随pH和温度的变化如图所示。溶液pH=4时,NaBH4_________(填“能”或“不能”)稳定存在,原因是_________(用离子方程式表示);T1_________T2。(填 “>”或“<”)











