-
硼(B)可形成 H3BO3、NaBH4 、NaBO2等化合物,用途广泛。
(1)H3BO3 为一元弱酸,可由硼砂(Na2B4O7﹒10H2O)与盐酸加热反应制得。该反应的化学方程式为____________________。 常温下 0.1 mol·L-1的H3BO3溶液 pH 约为5.0,则H3BO3的电离常数Ka约为____。
(2)在恒容密闭容器中发生储氢反应:BPO4(s)+4Na(s)+ 2H2(g) Na3PO4(s) + NaBH4(s) ΛH<0
Na3PO4(s) + NaBH4(s) ΛH<0
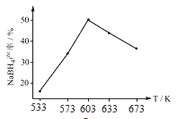
下图为NaBH4产率与反应温度的关系曲线:
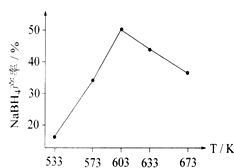
①反应达到平衡时,下列有关叙述正确的是_____。(填标号)
A.生成1mol NaBH4只需1mol BPO4、4mol Na和2 mol H2
B.若向容器内通入少量H2,则v(放氢)< v(吸氢)
C.升高温度,放氢速率加快,重新达到平衡时容器压强增大
D.降低温度,该反应的平衡常数减小
②NaBH4的产率在 603K之前随温度升高而增大的原因是___________________。
(3)NaBH4可水解放出氢气,反应方程式为:NaBH4 + 2H2O=NaBO2 + 4H2↑。
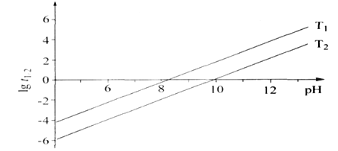
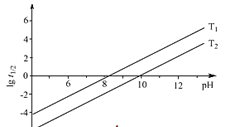
① t1/2为NaBH4水解的半衰期(水解一半所需要的时间,单位为分钟)。lgt1/2随 pH和温度的变化如图所示。在酸性条件下,NaBH4不能稳定存在,原因是_____(用离子方程式表示);T1__T2。(填“ >” 或“ <”)
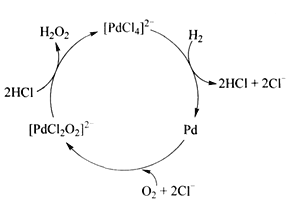
②用H2制备H2O2的一种工艺简单、能耗低的方法, 反应原理如下图所示。总反应的化学方程式为___________。
-
硼(B)可形成H3BO3、NaBH4、NaBO2等化合物,用途广泛。
(1)H3BO3为一元弱酸,常温下,在水中存在如下电离平衡:H3BO3 + H2O [B(OH)4]-+H+,Ka=5.72×10-10。
[B(OH)4]-+H+,Ka=5.72×10-10。
①25℃时,0.175 mol/L的H3BO3溶液pH约为_________。
②已知碳酸H2CO3的电离平衡常数为Ka1 = 4.4×10-7,Ka2 = 4.7×10-11。将少量碳酸钠溶液滴加到饱和硼酸溶液中,反应的离子方程式为_________。
(2)在容积恒定为2 L的密闭容器中加入足量BPO4和Na固体并充入一定量的H2(g)发生储氢反应:BPO4(s)+4Na(s)+2H2(g) Na3PO4(s)+NaBH4(s) △H<0
Na3PO4(s)+NaBH4(s) △H<0
①体系中H2的物质的量与反应时间的关系如表所示:
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n(H2)/mol | 2.0 | 1.5 | 1.2 | 0.9 | 0.8 | 0.8 |
下列有关叙述正确的是(填标号)_________。
a. 当容器内气体的摩尔质量不再变化时,反应达到平衡状态
b. 10 min时向容器内通入少量H2,则重新达平衡前ν(放氢)> ν(吸氢)
c. 保持温度不变,平衡后再充入1 mol H2,达新平衡时H2的浓度为0.4 mol/L
d. 升高温度,放氢速率加快,重新达到平衡时容器压强增大
②图为产率与反应温度的关系曲线,NaBH4的产率在603K之前随温度升高而增大,在603K之后随温度升高而减小的原因是_________。
(3)NaBH4(s)遇H2O(l)剧烈水解,生成氢气和NaBO2(s)。
①通常状况下,实验测得3.8 g NaBH4(s)发生水解反应放出21.6 kJ热量,写出该反应的热化学方程式_________。
② 为NaBH4水解的半衰期(水解一半所需要的时间,单位为min)。lg
为NaBH4水解的半衰期(水解一半所需要的时间,单位为min)。lg 随pH和温度的变化如图所示。溶液pH=4时,NaBH4_________(填“能”或“不能”)稳定存在,原因是_________(用离子方程式表示);T1_________T2。(填 “>”或“<”)
随pH和温度的变化如图所示。溶液pH=4时,NaBH4_________(填“能”或“不能”)稳定存在,原因是_________(用离子方程式表示);T1_________T2。(填 “>”或“<”)
③硼氢化钠具有极强还原性,碱性条件可用于处理电镀废液中的CuSO4制得纳米铜,从而变废为宝。写出电镀阳极反应方程式_______________。
-
硼氢化钠(NaBH4)是常用的还原剂,用途广泛。某探究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:
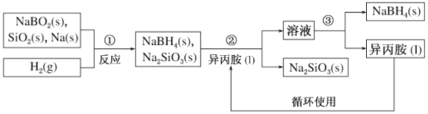
已知:NaBH4常温下易与水反应,可溶于异丙胺(沸点:33℃)
(1)在第①步反应加料之前,需要将反应器加热至 100 ℃以上并通入氩气 ,该操作的目的是______;第②步分离采用的方法是______;第③步分离NaBH4并回收溶剂,采用的方法是_____;
(2)NaBH4与水反应生成H2 : NaBH4 + 2H2O=NaBO2+4H2↑ (已知:HBO2是弱酸)。 实验测得,NaBH4每消耗一半所用的时间与溶液 pH、温度的关系如下表:
| pH | 8 | 10 | 12 | 1 4 |
| 温度/℃ | 25 | 25 | 25 | 25 |
| 时间/ min | 6. 2 ×10-1 | 6. 2 ×10 | 6. 2 ×103 | 6. 2 ×105 |
①NaBH4与水反应开始释放H2很快 ,经过一段时间后就缓慢下来 ,可能原因一是反应物浓度降低 ;二是________;
②为了加快制取的H2速率,常将一些促进剂投入水中,下列物质中可作为促进剂的是__;
a. 碳酸钾 b. 稀硝酸 c 硫酸氢钠 d. 氨水
(3)利用如图所示装置,可以测定NaBH4与水反应生成 H2的速率,在pH =10、25℃条件下,将恒压滴液漏斗中NaBH4滴加到含有催化剂的三颈烧瓶中。
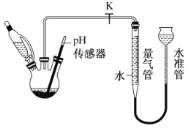
①实验中使用恒压滴液漏斗的原因为_________;
②气体生成结束后,水准管中的液面会高于量气管中的液面,此时量气管读数会_____( 填“偏大”或“偏小”)需要将水准管慢慢向下移动,则量气管中的液面会__________(填“上升”或“下降”);
③在此条件下,0. 38 g NaBH4开始反应至剩余 0. 19 g 时,实验测得量气管内气体体积为124mL,则这段时间内,生成H2的平均速率是_______mL·min-1。
-
硼酸(H3BO3)是有重要用途的一元弱酸。请回答下列问题:
(1)单质硼溶于热的浓硝酸可以生成硼酸,该反应的化学方程式为___________。
(2)利用铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)制硼酸,已知天然的Fe3O4不溶于酸。生产硼酸的工艺流程如下:
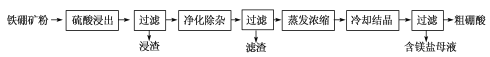
①“浸渣”主要成分的化学式为_____________。
②“净化除杂”:滤液保持一定温度,需先加H2O2溶液,然后再调节溶液的pH=5.6。温度不宜过高的原因是___________。调节溶液的pH=5.6的主要目的是___________。
[已知:Ksp[Fe(OH)3]=2.6×10-39], Ksp[Al(OH)3]=1.3×10-33,
[已知:Ksp[Fe(OH)2]=4.7×10-6], Ksp[Mg(OH)2]=5.6×10-12,
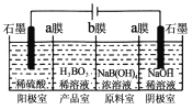
(3)硼酸也可以通过电解方法制备。工作原理如图所示。
①写出阳极的电极反应式___________________。
②a膜或b膜为阳离子交换膜的是________;阴极室溶液的浓度________(填“变大”、“不变”、“变小”)。
(4)写出一定条件下硼酸与氢氧化钠溶液反应的化学方程式_________________________。
-
硼酸(H3BO3)是有重要用途的一元弱酸。请回答下列问题:
(1)单质硼溶于热的浓硝酸可以生成硼酸,该反应的化学方程式为___________。
(2)利用铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)制硼酸,已知天然的Fe3O4不溶于酸。生产硼酸的工艺流程如下:
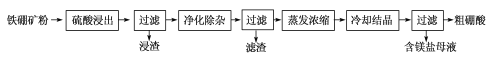
①“浸渣”主要成分的化学式为_____________。
②“净化除杂”:滤液保持一定温度,需先加H2O2溶液,然后再调节溶液的pH=5.6。温度不宜过高的原因是___________。调节溶液的pH=5.6的主要目的是___________。
[已知:Ksp[Fe(OH)3]=2.6×10-39], Ksp[Al(OH)3]=1.3×10-33,
[已知:Ksp[Fe(OH)2]=4.7×10-6], Ksp[Mg(OH)2]=5.6×10-12,
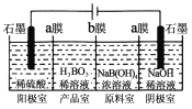
(3)硼酸也可以通过电解方法制备。工作原理如图所示。
①写出阳极的电极反应式___________________。
②a膜或b膜为阳离子交换膜的是________;阴极室溶液的浓度________(填“变大”、“不变”、“变小”)。
(4)写出一定条件下硼酸与氢氧化钠溶液反应的化学方程式_________________________。
-
硼酸(H3BO3)是有重要用途的一元弱酸。请回答下列问题:
(1)单质硼溶于热的浓硝酸可以生成硼酸,该反应的化学方程式为___________。
(2)利用铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)制硼酸,已知天然的Fe3O4不溶于酸。生产硼酸的工艺流程如下:
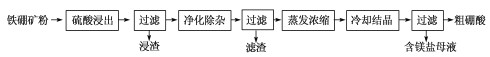
①“浸渣”主要成分的化学式为_____________。
②“净化除杂”:滤液保持一定温度,需先加H2O2溶液,然后再调节溶液的pH=5.6。温度不宜过高的原因是___________。调节溶液的pH=5.6的主要目的是___________。
[已知:Ksp[Fe(OH)3]=2.6×10-39], Ksp[Al(OH)3]=1.3×10-33,
[已知:Ksp[Fe(OH)2]=4.7×10-6], Ksp[Mg(OH)2]=5.6×10-12,
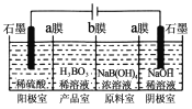
(3)硼酸也可以通过电解方法制备。工作原理如图所示。
①写出阳极的电极反应式___________________。
②a膜或b膜为阳离子交换膜的是________;阴极室溶液的浓度________(填“变大”、“不变”、“变小”)。
(4)写出一定条件下硼酸与氢氧化钠溶液反应的化学方程式_________________________。
-
硼氢化钠(NaBH4)在有机合成、化工生产方面有广泛应用。制备硼氢化钠的化学方程式为NaBO2+2SiO2+4Na+2H2 NaBH4+2Na2SiO3。下列有关上述反应的说法错误的是( )
NaBH4+2Na2SiO3。下列有关上述反应的说法错误的是( )
A. 氧化产物和还原产物的物质的量之比为2:1
B. 转移4 mol电子时,只需向装置中通入44.8 L H2(标准状况)
C. 装药品之前加热装置至100℃并持续一会儿
D. 制备硼氢化钠的副产物可能有NaH
-
硼氢化钠(NaBH4)在有机合成、化工生产方面有广泛应用。制备硼氢化钠的化学方程式为NaBO2+2SiO2+4Na+2H2 NaBH4+2Na2SiO3。下列有关上述反应的说法错误的是( )
NaBH4+2Na2SiO3。下列有关上述反应的说法错误的是( )
A. 氧化产物和还原产物的物质的量之比为2:1
B. 转移4 mol电子时,只需向装置中通入44.8 L H2(标准状况)
C. 装药品之前加热装置至100℃并持续一会儿
D. 制备硼氢化钠的副产物可能有NaH
-
硼氢化钠(NaBH4)在有机合成、化工生产方面有广泛应用。制备硼氢化钠的化学方程式为NaBO2+2SiO2+4Na+2H2 NaBH4+2Na2SiO3。下列有关上述反应的说法错误的是( )
NaBH4+2Na2SiO3。下列有关上述反应的说法错误的是( )
A. 氧化产物和还原产物的物质的量之比为2:1
B. 转移4 mol电子时,只需向装置中通入44.8 L H2(标准状况)
C. 装药品之前加热装置至100℃并持续一会儿
D. 制备硼氢化钠的副产物可能有NaH
-
完成下列填空:硼氧化钠(NaBH4)是合成中常用的还原剂。采用NaBO2为主要原料制备NaBH4(B元素化合价为+3)的反应为:NaBO2+SiO2+Na+H2 NaBH4+Na2SiO3(未配平);硅酸钠俗称泡花碱,又名水玻璃,在工业生产中也有广泛应用(已知硅酸为难溶性弱酸)
NaBH4+Na2SiO3(未配平);硅酸钠俗称泡花碱,又名水玻璃,在工业生产中也有广泛应用(已知硅酸为难溶性弱酸)
完成下列填空:
(1)上述反应中,原子最外层有两个未成对电子的元素是_____(填元素符号)。SiO2熔点高的原因是_____。
(2)上述反应中H2与Na的物质的量之比为_____。
(3)硅酸钠水溶液产生硅酸(H2SiO3),硬化粘结,且有碱性,其原因是_____(用离子方程式表示)。铸造工艺中可用氯化铵作为水玻璃的硬化剂。试用平衡原理加以解释_____。
(4)NaBH4可使许多金属离子还原成金属单质。例如它从含金离子(Au3+)的废液中提取Au.配平该反应的离子方程式:_____Au3++_____BH4﹣+_____OH-→_____Au+_____BO2﹣+_____H2O。
(5)最新研究发现以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,则每消耗1L6mol/L H2O2溶液,理论上流过电路中的电子数为_____。
Na3PO4(s) + NaBH4(s) ΛH<0












