-
(10分)蛇纹石可用于生产氢氧化镁,简要工程如下:
Ⅰ.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤,并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)
Ⅱ.提纯粗硫酸镁,将粗硫酸镁在酸性条件下溶解,加入适量的0.1mol/LH2O2溶液,再调节溶液pH至7~8,并分离提纯。
Ⅲ.制取氢氧化镁,向步骤II所得溶液中加入过量氨水。
已知:金属离子氢氧化物沉淀所需pH
| Fe3+ | Al3+ | Fe2+ | Mg2+ |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
请回答:
(1)步骤II中加入适量的0.1mol/LH2O2溶液的目的是 ;可用于调节溶液pH至7~8的最佳试剂是 (填字母序号)
A.MgO B.Na2CO3 C.蒸馏水 D.NaOH .
(2)工业上常以Mg2+的转化率为考查指标,确定步骤III制备氢氧化镁工艺过程的适宜条件。
其中,反应温度与Mg2+转化率的关系如图所示。
①步骤III中制备氢氧化镁反应的离子方程式为 。根据图中所示50℃前温度与Mg2+转化率之间的关系,可判断此反应是 (填“吸热”或“放热”反应)

②图中,温度升高至50℃以上Mg2+转化率下降的可能原因是 。
-
蛇纹石可用于生产氢氧化镁,简要工程如下:
Ⅰ.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤,并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)
Ⅱ.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1mol•L-1H2O2溶液,再调节溶液pH至7~8,并分离提纯.
Ⅲ.制取氢氧化镁:向步骤Ⅱ所得溶液中加入过量氨水.
| Fe3+ | Al3+ | Fe2+ | Mg2+ |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
已知:金属离子氢氧化物沉淀所需pH如表.
请回答:
(1)步骤Ⅱ中,可用于调节溶液pH至7~8的最佳试剂是______(填字母序号)
A.MgO B.Na2CO3 C.蒸馏水
(2)检验粗硫酸镁溶液中Fe2+的方法是:______ (注明试剂、现象).
(3)步骤Ⅲ中制备氢氧化镁反应的离子方程式为______.
(4)步骤Ⅱ沉淀后溶液中主要存在(NH4)2SO4,已知室温下0.1mol•L-1的(NH4)2SO4溶液pH是5,则溶液中离子浓度由大到小的排列为______,溶液中:2c(SO42-)-c(NH4+)=______mol•L-1(用精确数值表示)
(5)某生产科研小组经查阅资料得到以下溶度积Ksp数据(298K时):
Mg(OH)2(S)⇌Mg2+(aq)+2OH-(aq) Ksp=[Mg2+]•[OH-]2=5.6×10-12
Ca(OH)2(S)⇌Ca2+(aq)+2OH-(aq) Ksp=[Ca2+]•[OH-]2=4.7×10-6
该科研小组认为可以用熟石灰替代氨水制得氢氧化镁,他们的理由是______.
若沉淀转化反应为:Mg2+(aq)+Ca(OH)2(S)⇌Mg(OH)2(S)+Ca2+(aq),求此温度下该反应的化学平衡常数K=______ (写出算式和结果).
-
下列叙述正确的是 ( )
A.在中和热的测定实验中,应将碱液缓慢倒入酸液中,使反应充分进行
B.除去NaCl中少量的 ,可将固体混合物制成热饱和溶液,冷却结晶、过滤
,可将固体混合物制成热饱和溶液,冷却结晶、过滤
C.将硫代硫酸钠溶液和稀硫酸混合,可通过观察产生气泡的快慢来判断化学反应速率
D.将铁钉放试管中,加入2mL水、3滴稀醋酸和1滴 溶液,不久铁钉周围出现蓝色沉淀
溶液,不久铁钉周围出现蓝色沉淀
-
下列叙述正确的是 ( )
A.在中和热的测定实验中,应将碱液缓慢倒入酸液中,使反应充分进行
B.除去NaCl中少量的 ,可将固体混合物制成热饱和溶液,冷却结晶、过滤
,可将固体混合物制成热饱和溶液,冷却结晶、过滤
C.将硫代硫酸钠溶液和稀硫酸混合,可通过观察产生气泡的快慢来判断化学反应速率
D.将铁钉放试管中,加入2mL水、3滴稀醋酸和1滴 溶液,不久铁钉周围出现蓝色沉淀
溶液,不久铁钉周围出现蓝色沉淀
-
Ⅰ.高纯度氢氧化镁广泛应用于医药、电力等领域。镁硅酸盐矿石可用于生产氢氧化镁,简要工艺流程如图所示:
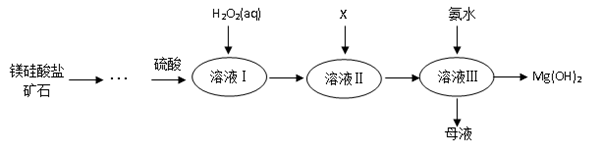
已知:
①溶液Ⅰ中除含Mg2+、SO42‒外,还含有少量Fe3+、Al3+、Fe2+等离子;
②常温下,几种金属离子开始沉淀和沉淀完全时的pH如下表所示:
| 金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
| 开始沉淀时的pH | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时的pH | 3.7 | 5.2 | 9.7 | 12.4 |
请回答下列问题:
(1)镁在元素周期表中的位置_______________;
(2)向溶液Ⅱ中加入试剂X是_____________,作用是_________________________;
(3)流程中不加H2O2引起的后果是___________________________________;
(4)说出母液的一种用途___________________;
(5)加入H2O2溶液发生反应的离子方程式是___________________;
Ⅱ.海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
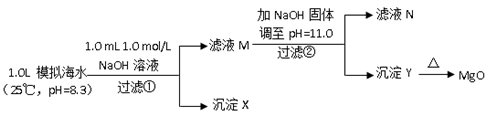
| 模拟海水中的离子浓度/ (mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;Ksp [Ca(OH)2]=4.68×10-6;Ksp [Mg(OH)2]=5.61×10-12。请回答下列问题:
(6)沉淀物X为_____________;
(7)滤液N中Ca2+浓度为_______________;
(8)加NaO H固体调整pH=12.5是否可行______(填“是”“否”);原因是________。
H固体调整pH=12.5是否可行______(填“是”“否”);原因是________。
-
蛇纹石矿可以看做是由MgO、 、
、 、
、 组成.由蛇纹石制取碱式碳酸镁的实验步骤如下:
组成.由蛇纹石制取碱式碳酸镁的实验步骤如下:
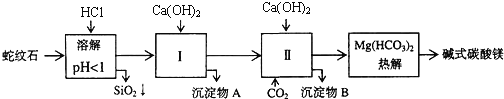
(1)蛇纹石矿加盐酸溶解后,溶液里除了 外,还含有的金属离子是 ______
外,还含有的金属离子是 ______
(2)进行Ⅰ操作时,控制溶液 有关氢氧化物沉淀的pH见上表
有关氢氧化物沉淀的pH见上表 不能过量,若
不能过量,若 过量可能会导致 ______ 溶解、 ______ 沉淀生成.
过量可能会导致 ______ 溶解、 ______ 沉淀生成.
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入 ______  填入物质的化学式
填入物质的化学式 ,然后 ______
,然后 ______  依次填写实验操作名称
依次填写实验操作名称 .
.
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是 ______  填写物质化学式
填写物质化学式 .
.
(5)若热分解不完全,所得碱式碳酸镁中将混有 ,则产品中镁的质量分数 ______
,则产品中镁的质量分数 ______  填“升高”、“降低”或“不变”,已知碳酸镁的相对分子质量为84,碱式碳酸镁的相对分子质量大于
填“升高”、“降低”或“不变”,已知碳酸镁的相对分子质量为84,碱式碳酸镁的相对分子质量大于 .
.
-
(12分)白炭黑(SiO2·H2O)广泛用于橡胶、涂料、印刷等行业,可用蛇纹石[主要成分为Mg(SiO10)(OH)3]来制取,其主要工艺流程如下:
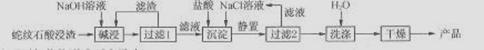
(1)蛇纹石用氧化物形式可表示为________。
(2)碱浸时,为提高其中硅酸盐的浸取率,除采用合适的液固比和循环浸取外,还可采用的方法有①;②________(任举两种)。
(3)过滤1得到的滤液的主要成分是________。
(4)沉淀时加入氯化钠溶液的作用可能是________。
(5)洗涤时,如保证明产品已洗涤干净?________。
-
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制取碱式碳酸镁的实验步骤如下
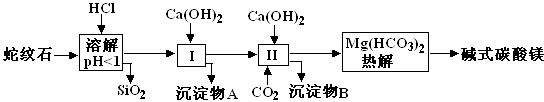
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是______.
(2)进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见表)Ca(OH)2不能过量,若Ca(OH)2过量可能会导致______溶解、______沉淀.
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入______ (填入物质的化学式),然后______ (依次填写实验操作名称).
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是______(填写物质化学式).
(5)现设计一个实验,确定产品aMgCO3•bMg(OH)2•cH2O中a、b、c的值(已知均为正整数),请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):①样品称量 ②高温分解 ③______ ④______ ⑤称出MgO的质量.
-
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下
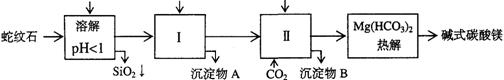
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是_____________
(2)进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见上表)
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致_________溶解、_________沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入_________ (填入物质的化学式),然后__________________________________ (依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是_____________(填写物质化学式)。
(5)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下CO20.896L,通过计算确定碱式碳酸镁的化学式________。
(6)若热分解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数 (填 “升高”、“降低”或“不变”)。
-
下列装置用于实验室以硫酸铝制取一定量Al2O3,能达到实验目的的是
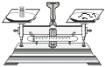
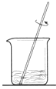
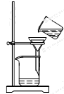
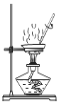
A.称取样品 B.样品溶解 C.沉淀过滤 D.灼烧氢氧化铝沉淀










