-
某化学学习小组的同学 依据氧化还原反应:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,可采用滴定的方法测定FeSO4的质量分数,实验步骤如下:
①称量绿矾样品30.4g,配成100mL待测溶液
②取10.0ml待测液置于锥形瓶中,并加入一定量的硫酸
③将0.1mol•L-1的KMnO4溶液装入滴定管中,调节液面至8.00mL处
④滴定待测液至滴定终点时,滴定管的液面读数18.00mL(其中的杂质不跟高锰酸钾和稀硫酸反应)。请回答下列问题:

(1)滴定时用________(填右图的“甲”或“乙”)滴定管盛装KMnO4标准溶液;
(2)滴定前是否要滴加指示剂?________(填“是”或“否”),请说明理由________;
(3)本实验达到终点的标志是________;
(4)样品中FeSO4的质量分数为________;
(5)误差分析(选填“偏高”“偏低”或“无影响”)
①开始实验时酸式滴定管尖嘴处有气泡,在滴定过程中气泡消失________
②若滴定前仰视滴定管刻度读数时,则会使滴定结果________
-
某实验小组为了分析补血剂 FeSO4·7H2O 中铁元素的质量分数,用 KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4- +8H+= 5Fe3++Mn2++4H2O。
(1)实验前,首先要精确配制一定物质的量浓度的 KMnO4 溶液 250 mL,配制时需要用的仪器除天平、药匙、玻璃棒、烧杯、胶头滴管外,还需____________。
(2)滴定前是否要滴加指示剂?_____(填“是”或“否”),理由是_____。
(3)某同学设计的下列滴定方式中,最合理的是_____(填序号)
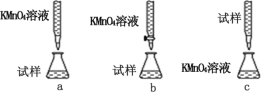
(4)该实验小组称取 12.0 g 补血剂在容量瓶中配成 100 mL 溶液,量取 25.00 mL 试样溶液, 用 0.100 mol·L-1 KMnO4标准溶液滴定。 达到滴定终点时, 消耗标准溶液20.00 mL,则所测补血剂中铁元素的质量分数是_____(精确至 0.01%)。
(5)若该小组配制溶液和滴定操作时引起的误差忽略,最终所测补血剂中铁元素含量 仍偏小,其可能原因是_____。
-
实验室用KMnO4溶液滴定能进行每片补血剂含铁元素(Fe2+)含量的测定,化学原理为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O.下列滴定方式中(夹持部分略去),最合理的是( )
A.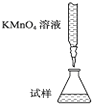
B.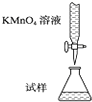
C.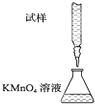
D.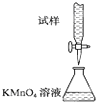
-
对于溶液中的反应:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O,下列措施能使化学反应速率提高的是
A. 加水 B. 增加同浓度FeSO4的用量
C. 向溶液中滴加稀硫酸 D. 加入少量KMnO4晶体
-
在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO4-+5e-+8H+===Mn2++4H2O
(1)写出该氧化还原反应的离子方程式:_______________________。
(2)反应中氧化剂是________;被氧化元素是__________;若有0.5 mol H2O2参加此反应,电子转移个数为____________。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为________________________;这时若有0.5 mol H2O2发生分解,电子转移个数为__________________。
-
下列说法正确的是( )
A.根据反应5Fe2++MnO4ˉ+8H+=5Fe3++Mn2++4H2O可知:用酸性KMnO4溶液可检验绿矾(FeSO4·7H2O)是否变质
B.根据反应Fe+4HNO3=Fe(NO3)2+2NO2↑+2H2O可知:反应中HNO3表现酸性和氧化性
C.根据反应CuSO4+H2S=CuS↓+H2SO4可知:H2S的酸性比H2SO4强
D.根据反应H3PO3+2NaOH(足量)=Na2HPO3+2H2O可知:H3PO3属于三元酸
-
下列说法正确的是( )
A.根据反应5Fe2++MnO4﹣+8H+═5Fe3++Mn2++4H2O可知:用酸性KMnO4溶液可检验绿矾(FeSO4•7H2O)是否变质
B.根据反应H3PO3+2NaOH(足量)═Na2HPO3+2H2O可知:H3PO3属于三元酸
C.根据反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O可知:反应中HNO3表现酸性和氧化性
D.根据反应CuSO4+H2S═CuS↓+H2SO4可知:H2S的酸性比H2SO4强
-
下列说法正确的是
A.根据反应5Fe2++MnO4﹣+8H+═5Fe3++Mn2++4H2O可知:用酸性KMnO4溶液可检验绿矾(FeSO4•7H2O)是否变质
B.根据反应H3PO3+2NaOH(足量)═Na2HPO3+2H2O可知:H3PO3属于三元酸
C.根据反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O可知:反应中HNO3表现酸性和氧化性
D.根据反应CuSO4+H2S═CuS↓+H2SO4可知:H2S的酸性比H2SO4强
-
(10分)许多物质的氧化能力受溶液酸碱性的影响。高锰酸钾在不同条件下发生的还原反应如下:
①酸性:MnO4-+5e-+8H+→Mn2++4H2O;
②中性:MnO4-+3e-+2H2O→MnO2+4OH-
③碱性:MnO4-+e-→MnO42-(溶液呈绿色)
MnO2的还原反应可表示如下:MnO2+4H++2e-→Mn2++2H2O
(1)MnO2与稀盐酸不能制取氯气,其原因是___________________________________。
(2)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色。下列叙述正确的是_______。(选填编号)
a.氧化性:PbO2>KMnO4 b.还原性:PbO2>KMnO4 c.该反应可以用盐酸酸化
(3)写出将SO2通入KMnO4溶液中所发生反应的离子方程式,并配平:
________________________________________________________________________。
(4)将高锰酸钾溶液逐滴加入到硫化钾溶液中可发生如下反应,已知产物中K2SO4和S的物质的量之比为3∶2。完成并配平该反应的化学方程式:
□KMnO4+□K2S+□__________→□K2MnO4+□K2SO4+□S↓+□__________,反应若生成5.44 g硫单质,反应过程中转移电子的物质的量为__________________。
-
下列说法正确的是( )
A.根据反应H3PO3+2NaOH(足量)=Na2HPO3+2H2O可知:H3PO3属于三元酸
B.根据反应5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O可知:用酸性KMnO4溶液可检验绿矾(FeSO4·7H2O)是否变质
C.根据反应CuSO4+H2S=CuS↓+H2SO4可知:H2S的酸性比H2SO4强
D.根据反应3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O可知:反应中HNO3表现酸性和氧化性





