-
硫酸工业用SO2制取SO3的反应为:2SO2+O2 2SO3△H=﹣47kJ/mol.不同温度下,反应的平衡常数如表:
2SO3△H=﹣47kJ/mol.不同温度下,反应的平衡常数如表:
| 温 度 | 200℃ 300℃ 400℃ |
| 平衡常数 | K1 K2 K3 |
(1)反应的平衡常数表达式为=
(2)下列描述中能说明上述反应已达到平衡的是 (填序号)
a.v(O2)正=2v(SO3)逆
b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(3)在上述平衡体系中加入18O2,当平衡发生移动后,SO2中18O的百分含量 (填增加、减少、不变)其原因是 .
(4)一定温度下,把2molSO2和1molO2通入一恒容密闭容器中,平衡时SO3的体积分数为x.保持温度不变,若初始加入的SO2、O2和SO3的物质的量分别为a、b、c,当a、b、c的取值满足下列关系时才能保证达到平衡时SO3的体积分数仍为x.① (填a与c的关系)、② (填b、c的关系).
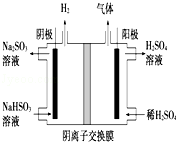
(5)工业上用Na2SO3吸收尾气中的SO2,再用如图装置电解(惰性电极)NaHSO3制取H2SO4,阳极电极反应式 ,阳极区逸出气体的成分为 (填化学式).
-
二氧化硫的催化氧化是工业上生产硫酸的主要反应,反应如下:
I:2SO2(g)+O2(g) 2SO3(g) △H1=-197.7kJ·mol-1 K1(浓度平衡常数)
2SO3(g) △H1=-197.7kJ·mol-1 K1(浓度平衡常数)
为研究该反应,某同学设计了以下三种已装固体V2O3催化剂的密闭容器装置

(1)在初始体积与温度相同的条件下,甲、乙、丙中均按2 mol SO2、1molO2投料,达平衡时,三个容器中SO2的转化率从大到小的顺序为___________(用“甲、乙、丙”表示)。
(2)在容器丙中,0.1MPa条件下,在不同温度或不同投料方式下研究上述反应得到数据如下表:
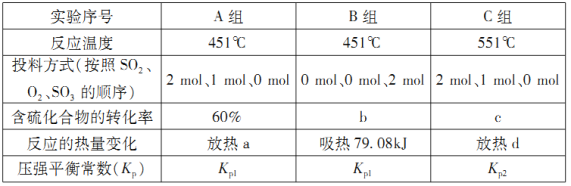
①表中:a=___________;b=___________。
②已知用平衡分压(分压=总压×物质的量分数)代替平衡浓度计算,得到的平衡常数即为压强平衡常数,则Kp1=___________;Kp1___________Kp2(填“>”、“<”或“=”)。
③若按0.4 mol SO2、0.4molO2、0.4 mol SO3进行投料,则反应开始时v正(SO2)_______v逆(SO2)(填“>”、“<”或“=”)。
(3)将上述固体催化剂V2O5换成NO2气体同样可以对该反应起到催化作用,此催化过程如下:
Ⅱ:SO2(g)+NO2(g) SO3(g)+NO(g) △H2 K2(浓度平衡常数)
SO3(g)+NO(g) △H2 K2(浓度平衡常数)
Ⅲ:2NO(g)+O2(g) 2NO2(g) △H3=-114.1kJ·mol-1 K3(浓度平衡常数)
2NO2(g) △H3=-114.1kJ·mol-1 K3(浓度平衡常数)
△H2=___________;K3=___________(用含有K1、K2的表达式表示)。
-
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知:SO2(g)+ O2(g)
O2(g) SO3(g) △H=-98 kJ·mol-1。
SO3(g) △H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K= ,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) ________ v(逆)(填“<”、“>”或“=”)。
,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) ________ v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 molO2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为________。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入1.0 mol SO3
C.降低温度
D.移动活塞压缩气体
(4)若以如图所示装置,用电化学原理生产硫酸, 写出通入O2电极的电极反应式为________。
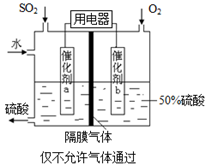
(5)为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为_____。
-
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
已知:SO2+ O2⇌SO3△H=-98KJ•mol-1
O2⇌SO3△H=-98KJ•mol-1
(1)在T1温度时,该反应的平衡常数 ,若在此温度下,向100L的恒容密闭容器中,充入3.0molSO2、16.0molO2和3.0molSO3,则反应开始时正反应速率______逆反应速率(填“<”、“>”或“=”).
,若在此温度下,向100L的恒容密闭容器中,充入3.0molSO2、16.0molO2和3.0molSO3,则反应开始时正反应速率______逆反应速率(填“<”、“>”或“=”).
(2)在T2温度时,开始在100L的密闭容器中加入4.0molSO2和10.0molO2,一定条件下当反应达到平衡时共放出热量196kJ.此时二氧化硫的转化率为______.
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2平衡浓度比原来减小的是______(填字母).
A.保持温度和容器体积不变,充入1.0molO2
B.保持温度和容器内压强不变,充入2.0molSO2和5.0molO2
C.降低温度
D.在其他条件不变时,减小容器的容积
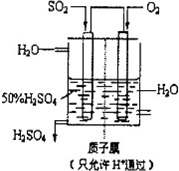
(4)有人设想以如图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:______.
(5)由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种沉淀共存时, =______.[已知该温度时,
=______.[已知该温度时, ,
, ].
].
-
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤,已知
SO2(g)+ O2(g)
O2(g) SO3(g)△H=-98 kJ·mol-1。
SO3(g)△H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K= ,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol
,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol
SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v正________________________________ ________________________________v逆(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 molO2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为________________________ ________________________________。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________________ ________________________(填字母)。
A保持温度和容器体积 不变,充入1.0 mol O2
不变,充入1.0 mol O2
B保持温度和容器内压强不变,充入1.0 mol SO3
C降低 温度
温度
D移动活塞压缩气体
(4)若以右图所示装置,用电化学原理生产硫酸,写出通入O2电极的电极反应式为________________________ ________________________________________________。

(5)为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为________________________________________________________ 。
-
(10分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:
SO2(g) +1/2O2(g) SO3(g) △H=-98 kJ·mol-1。
SO3(g) △H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) ________v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为________。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的
是________(填字母)。
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入1.0 mol SO3
C.降低温度
D.移动活塞压缩气体
(4)若以下图所示装置,用电化学原理生产硫酸,写出通入O2电极的电极反应式为________;
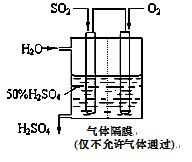
为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为____________________。
-
(10分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:
SO2(g) +1/2O2(g) SO3(g) △H=-98 kJ·mol-1。
SO3(g) △H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) ________v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为________。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的
是________(填字母)。
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入1.0 mol SO3
C.降低温度
D.移动活塞压缩气体
(4)若以下图所示装置,用电化学原理生产硫酸,写出通入O2电极的电极反应式为________;
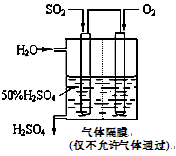
为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为____________________。
-
SO2的催化氧化是工业制取硫酸的关键步骤之一:2SO2 + O2 2SO3 在容积均为2L,有相同催化剂的a、b、c、d、e五个密闭容器中均充入2mol SO2和1mol O2混合气体,控制不同的反应温度。反应进行5min时,测得相关数据如下表:
2SO3 在容积均为2L,有相同催化剂的a、b、c、d、e五个密闭容器中均充入2mol SO2和1mol O2混合气体,控制不同的反应温度。反应进行5min时,测得相关数据如下表:
| 容器温度 物质的量(mol) | a容器 400℃ | b容器 425℃ | c容器 450℃ | d容器 475℃ | e容器 500℃ |
| O2 | x | 0.6 | 0.3 | 0.5 | 0.7 |
| SO3 | y | 0.8 | 1.4 | 1.0 | 0.6 |
(1)5min时测得a容器中混合气体的物质的量减少了0.2mol,计算5min内SO3的平均反应速率____________。
(2)反应进行到5min时,b容器中的反应是否达到平衡状态?_______(填“是”或“否”),理由是:_____________________________________________________________________________。
(3)在图中画出e容器中SO2物质的量随时间的变化曲线_______________________。
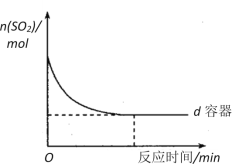
(4)工业上常用Na2SO3溶液来吸收SO2,该反应的离子方程式是:___________________。
(5)已知NaHSO3溶液呈酸性,溶液中c(H2SO3)_______ c(SO32—)(选填<、>或=);NaHSO3既能和强酸反应也能和强碱溶液反应。用平衡移动原理说明NaHSO3能和强碱溶液反应的原因:_______________
-
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)⇌2SO3(g);△H=-190KJ/mol
(1)该反应的平衡常数表达式是________,该反应450℃时的平衡常数________ 500℃时的平衡常数(填“大于”、“小于”或“等于”).
(2)说明反应达到平衡状态是________.
a. V(O2)正=2V(SO3)逆 b.ひ(SO2)正׃ひ(O2)逆=2:1
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
e.容器中气体的平均分子量不随时间而变化
(3)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则V(O2)=________mol.L-1.min-1:若继续通入0.30mol SO2和0.15mol O2,则平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol<n(SO3)<________mol.
-
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知: §SO2(g) +1/2O2(g) SO3(g)+ 98 kJ
SO3(g)+ 98 kJ
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正)
________v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为20 L的密闭容器中充入0.4 mol SO2和0.2 mol O2,达到平衡后体积变为16 L,则平衡后SO2转化的百分率为________。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
A.保持温度和容器体积不变,充入0.2 mol O2
B.保持温度和容器内压强不变,充入0.4 mol SO3
C.降低温度
D.移动活塞压缩气体
(4)若以下图所示装置,用电化学原理生产硫酸, 为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为____________。

2SO3△H=﹣47kJ/mol.不同温度下,反应的平衡常数如表:









