-
(本题共10分)
利用镁和稀硫酸反应,不仅可以测定1mol氢气的体积,装置如下左图,也可以测定镁带中镁的质量分数(杂质与酸反应不产生气体),装置如下右图。
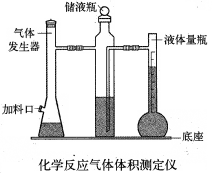
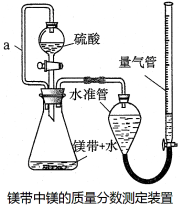
32.用离子方程式表示测定实验的反应原理 。
-
利用镁和稀硫酸反应,不仅可以测定1mol氢气的体积,装置如下左图,也可以测定镁带中镁的质量分数(杂质与酸反应不产生气体),装置如图。
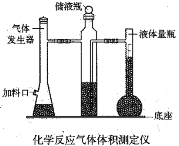
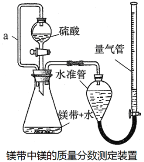
(1)用离子方程式表示测定实验的反应原理____________________________________。
(2)硫酸必须过量的目的是__________________________________________________。
(3)用“化学反应气体体积测定仪”测定1mol氢气的体积时,要三次用到注射器,其中两次是抽气调压,还有一次是___________________________________________。
(4)a(g)镁和足量稀硫酸反应,镁完全反应后,测得氢气在常温时的体积为V(L),则常温下l mol氢气的体积为_________________L。
(5)某学生在测定1molH2体积时,镁中混有少量铝,测定结果将_______________(填:偏大、偏小或没有变化)。
(6)若用“化学反应气体体积测定仪”也可以测定1mol二氧化碳气体的体积,那么储液瓶中应盛放________________________溶液。
(7)在“镁带中镁的质量分数测定装置”中,导管a的作用是______________________。
(8)“镁带中镁的质量分数测定”中,读取量气管的读数时,要使装置内外压强保持一致,具体操作为_________________________________________________________。
(9)在“镁带中镁的质量分数测定”中,如果实验的测定结果偏高,可能的原因是____________(选填编号)。
a.装置漏气 b.未冷却至室温即读数
c.镁带中含有氧化镁 d.末读数时量气管的液面低于水准管
-
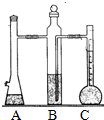
利用如图装置可以测定常温下1mol氢气的体积,某同学的实验数据以及计算结果如下:
温度:10℃压强:1atm
| 实验次数 | 镁带质量(g) | 硫酸体积(ml) | C装置中液体的体积(ml) | 最后抽气的体积(ml) | 氢气的体积(ml) | 计算1mol氢气的体积(L) |
| ① | 0.125 | 10 | 128.5 | 3.0 | 121.5 | 23.34 |
| ② | 0.133 | 10 | 135.5 | 3.0 | 128.5 | 23.19 |
| ③ | 0.127 | 10 | 129.7 | 3.0 | 122.7 | 23.19 |
(1)写出镁与硫酸反应的化学方程式:______
(2)写出仪器名称:A______B______C______
(3)有同学认为上述实验中的第______次实验明显造假,其理由是______.
(4)此条件下1mol氢气的体积是(平均)=______L(保留2位小数)
(5)实验误差=______%(已知在此条件下1mol氢气的体积理论值为23.15L,保留2位小数).
(6)造成误差的可能原因有______
A、镁条表面的氧化物没有除 B、实验以后没有抽气
C、液体量瓶读数时俯视 D、镁带中含有少量的铝.
-
(10分)在常温常压下,可利用下列装置来测定气体体积,抽气装置E用以调节装置中的气压差,减小实验误差。
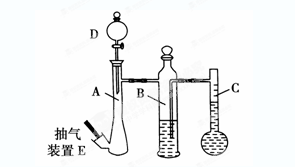
(1)若称取0.113g镁带与10.00 mL稀硫酸(足量)完全反应制取氢气,并测定1mol H2的体积(在常温常压下测定)。反应结束时C中的液面刻度为128.00 mL(A中未加硫酸时C中无液体),则得此条件下1mol H2的体积为________L(精确到0.001)。
(2)上述测出1mol H2的体积比该温度和压强下的理论值偏高的原因是(假设操作和装置都无问题)________(选填编号,下同)
A.未冷却到室温 B.反应太快
C.装置气密性不好 D.B装置漏气
(3)若利用上述装置测定CO2的气体摩尔体积。
①B中所盛放的液体应为________。
A.饱和Na2CO3溶液 B.饱和NaHCO3溶液
C.水 D.澄清石灰水
②仪器A、D中盛放的试剂应为________。
A.大理石,浓盐酸 B.纯碳酸钠,稀硫酸
C.纯碳酸钙,稀硫酸 D.纯碳酸钠,稀盐酸
(4)用以上装置测出的气体摩尔体积均比理论值大,你认为减小实验误差可行的措施是_______。
A.把A装置浸入盛水(常温)的水槽中
B.减小酸的浓度
C.把A装置浸入盛热水的水槽中
D.增大酸的浓度
-
下列关于测定1mol氢气体积的操作中,错误的是
A.保证装置不漏气
B.镁带称量后,用砂皮擦去表面的氧化层
C.用针筒注入硫酸后,拔出速度要快
D.镁带的质量要使产生的氢气足以计量
-
某纯碱样品中含有少量氯化钠,现欲测定其碳酸钠的质量分数,设计如下实验方案:
(方案1)称取一定质量的纯碱样品(已知锥形瓶和硫酸溶液的质量190.720 g),利用左图装置测定纯碱样品的纯度,每隔相同时间读得电子天平的数据如表:
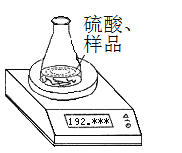
| 读数次数 | 质量(g) |
| 锥形瓶+硫酸+试样 | 第1次 | 192.955 |
| 第2次 | 192.764 |
| 第3次 | 192.328 |
| 第4次 | 192.075 |
| 第5次 | 192.075 |
(1)计算纯碱样品的纯度时,必需的数据是_____________________________(填具体数据)。不必作第6次读数的原因是________________________________________________。
(2)计算纯碱样品的纯度为_________________________(保留小数后两位)。
(方案2)测定上述样品(1.15 g)中,Na2CO3质量分数的另一种方案,其操作流程如下:
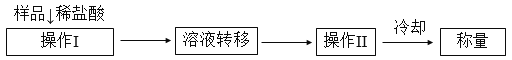
(1)溶液转移至__________(填写仪器名称),操作II的名称是______________。
(2)需直接测定的物理量是____________________。
(3)测定过程中需要的仪器有电子天平.蒸发皿、酒精灯、还需要__________、__________(固定、夹持仪器除外)。
(4)在转移溶液时,如溶液转移不完全,则Na2CO3质量分数的测定结果__________(填“偏小”、“偏大”或“不变”)
(方案3)实验装置如图:
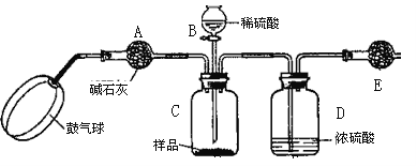
实验步骤:
①如图连接装置并加入所需药品。
②称量并记录E的质量m1(称量时注意封闭E的两端)。
③按动鼓气球,持续约1分钟。
④连接上E。
⑤打开分液漏斗B的活塞,将稀硫酸快速加入C中后,关闭活塞。
⑥按动鼓气球,持续约1分钟。
⑦称量并记录E的质量m2(称量时注意封闭E的两端及D右端的出口)。
⑧重复步骤⑥和⑦的操作,直到球形干燥管的质量基本不变,记为m3。
⑨计算。
请填空和回答问题:
(1)C中发生反应的离子方程式为:______________________________________。B仪器的名称为__________。如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果将__________(填“偏高”、“偏低”或“不变”)。
(2)浓硫酸的作用是_________________,若没有D,则实验结果__________(填“偏高”、“偏低”或“无影响”)。
(3)步骤③和⑥的作用是____________________,____________________。鼓气球的速度是快速好,还是缓慢鼓入?为什么?__________________________________________。
(4)E装置的固体试剂为__________(填编号)
A.碱石灰 B.无水氯化钙 C.浓硫酸 D.生石灰
(5)步骤⑧的目的是________________________________________________。
(6)试样中纯碱样品的质量分数计算式为_____________________________________。
(7)本实验设计中若有需要改进的地方,请指出该进之处并说明原因。
_______________________________________________________________________。
(8)实验还可以用其它定量实验方法测定试样中纯碱的质量分数,请简述一种不同的定量实验方法。___________________________________________________________ 。
-
如图是用于通过测定单位时间内产生气体的体积来测量反应速率的装置,下列说法中正确的是( )
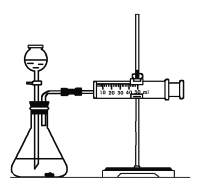
A. 如果在分液漏斗中加入稀硫酸,在锥形瓶中加入纯锌比加入粗锌产生氢气速率快
B. 如果在分液漏斗中加入浓硫酸,在锥形瓶中加入粗锌比加入纯锌产生氢气快
C. 在锥形瓶中加入纯锌,在分液漏斗中加入稀硫酸比加入稀硫酸和少量硫酸铜产生氢气速率快
D. 在锥形瓶中加入纯锌,在分液漏斗中加入稀硫酸和少量硫酸铜比加入稀硫酸产生氢气速率快
-
在测定1mol气体体积的实验中,若镁条中含有不与稀硫酸反应的杂质,其他步骤均无误差,则测定结果会
A. 偏大 B. 偏小 C. 不影响 D. 都有可能
-
用如图所示装置测定镁带样品中单质的质量分数(杂质与酸反应不产生气体)。完成下列填空:
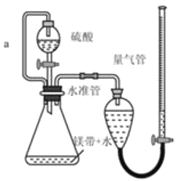
(1)用离子方程式表示该实验的反应原理:____________。
(2)称量镁带所需的定量仪器是 _______________。
(3)硫酸必须过量的目的是_____________。
(4)导管a的作用是 ____________ 。
(5)如果测定结果偏高,可能的原因是____________。(选填编号)
a 装置漏气 b 未冷却至室温即读数
c 镁带中含有氧化镁 d未读数时量气管的液面低于水准管
-
为测定某铝镁合金中镁的质量分数,某小组计划将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。填写下列空白。
(1)同学们选用甲装置进行实验:实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸就不能顺利滴入锥形瓶。请你帮助分析原因是________________。
(2)同学们经讨论认为甲装置有两个方面会引起较大误差,分别是__________和__________。
(3)于是他们设计了实验装置乙。乙中导管a的作用是__________。若实验前后滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为______mL。












