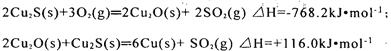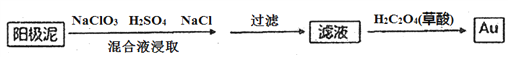-
铜和铜合金广泛用于电气、机械制造、建筑工业、国防工业等领域。
(1)以含Cu2S80%的精辉铜矿为原料冶炼金属铜( )。若生产含Cu量为97.5%的粗铜48t,则生产SO2_________L(标准状况下);需要精辉铜矿_______t(保留一位小数)。
)。若生产含Cu量为97.5%的粗铜48t,则生产SO2_________L(标准状况下);需要精辉铜矿_______t(保留一位小数)。
(2)高温时,Cu2S和O2在密闭容器中实际发生的反应为以下两步:
2Cu2S+3O2 2Cu2O+ 2SO2、2Cu2O+ Cu2S
2Cu2O+ 2SO2、2Cu2O+ Cu2S 6Cu+ SO2↑
6Cu+ SO2↑
取amol Cu2S和bmol空气(设氧气占空气体积的20%)在高温下充分反应。根据下列几种情况回答问题(反应前后温度、容器体积不变):
①若反应后剩余固体只有Cu,则a和b的关系是___________。
②若反应后剩余固体是Cu2S和Cu,则反应前容器内压强(P1)与反应后容器内压强(P2)的关系是_______。
③若反应后容器内的压强小于反应前,通过分析,确定反应前后容器内固体的成分___________。
(3)可用纯度为80%的精辉铜矿制备胆矾。称取8.0g矿样,溶解在40mL14.0mol/L的浓硝酸中(杂质不反应),反应为: 2Cu2S+14H++10NO3-→4Cu2++2SO42-+5NO↑+5NO2↑+7H2O。过滤后向所得溶液再加入适量的铜和稀硫酸,充分反应前后,将该溶液蒸发结晶。计算理论上最多可得到CuSO4·5H2O晶体多少克_______?
-
铜是有色金属,被广泛地应用于电气、轻工、机械制造、建筑工业、国防工业等领域,铜的冶炼和加工对于现代社会有着重要的意义。
(1)工业上可用黄铜矿冶炼粗铜,简要流程如下:

在转炉中,经过两步反应生成粗铜,其的热化学方程式分别为:
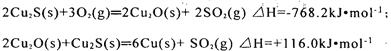
则总反应的热化学方程式为:_______________________________________;
(2)粗铜可用电解法精炼,电解过程中,粗铜应做____极;精铜一侧电极反应式为__________;
(3)电解精炼时粗铜中Fe、Zn等杂质元素会进入电解质溶液,一段时间后需要对电解液除杂净化,其中除去铁元素的一种操作如下:

下表为部分阳离子以氢氧化物形式沉淀时溶液的pH:

①试剂a是_______________,其作用是_________________________________________;
②溶液A加入CuO调节pH的目的是________________________________________(用必要的离子方程式和适当的文字说明)。
③操作①名称是________________。
(4)电解槽阳极泥中含有Ag、Au等贵金属,分离提纯Au的工艺流程如下:
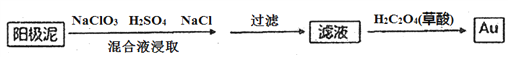
①滤液中Au元素的存在形式为[AuC14]-,写出浸取步骤反应的离子方程式________________。
②加入草酸后,滤液中发生氧化还原反应,生成Au单质,该反应中氧化剂和还原剂的物质的量之比为____________。
-
铜是人类最早使用的金属之一。也是中学中常见的过镀金属元素。铜是与人类关系非常密切的有色金属。被广泛地作力导线应用于电气、轻工、机械制造、建筑工业、国防工业等领域在中国有色金属材料的消费中仅次于铝。回答下列问题:
(1)基态Cu+原子核外电子排式为___。
(2)CuCl晶体的晶格能可通过如图的Born-Haber循环计算得到:
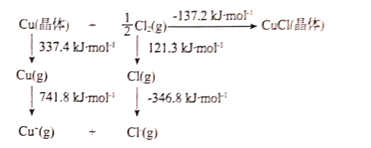
铜原子的第一电离能为___kJ•mol-1;Cl-Cl键键能为___kJ•mol-1;CuCl的晶格能为___kJ•mol-1。
(3)铜盐属于重金属盐,铜盐中毒可用青霉胺解毒,解毒原理如下:Cu2+能与青霉胺成环状络合物,该环状络合物无毒、易溶于水,可经尿液排出。
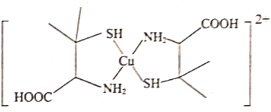
①青霉胺分子中S原子的轨道杂化类型为___;
②硫化氢与氨气键角的大小:H2S___NH3(填“>”或“<”)。
③第二周期元素中,第一电离能大于N的元素有___(用元素符号表示)。
④该环状络合物无毒、易溶于水,可经尿液排出,请解释该化合物易溶于水的主要原因:___。
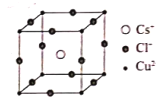
(4)某含铜的离子化合物M由Cs、Cu、Cl三种元素构成,M属于立方体晶系的离子晶体,其结构如图所示。试回答下列问题:
①离子化合物M的化学式为___;
②已知Cs和Cl两元素离子的半径大小相近,该晶体中两种离子联合组成何种形式的密堆积___;
③若晶胞参数为anm,则这种晶体密度为___g•cm-3(用含a、和NA的式子表示)。
-
金属钨广泛用于冶金、机械、建筑、电子等领域。以黑钨精矿为原料冶炼钨的流程如图所示:
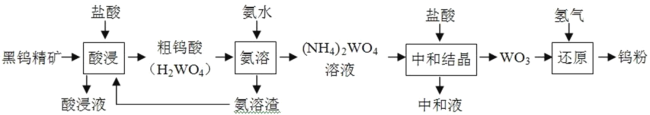
请回答下列问题。
(1)“酸浸液”中含有 Fe3+、Fe2+等金属离子,检验其中的 Fe2+常使用铁氰化钾溶液,反应的离子方程式 为_____。
(2)“氨溶”时需加热,但应控制温度不超过 70℃的原因为_____。
(3)“中和结晶”时(NH4)2WO4 与盐酸反应生成 WO3 的化学方程式为_____,所得“中和 液”的主要溶质的电子式为_____。
(4)流程图中设计将“氨溶渣”返回“酸浸”过程的目的为__________。
(5)钨钛合金在工业中应用广泛, NH4Fe(SO4)2 滴定法可测定合金中钛的含量:称取 w g 钨钛合金,用 HNO3-HF混合液溶解,用 NaOH 溶液沉淀并分离钛元素后加盐酸溶解,用金属铝将 Ti4+还原为 Ti3+,向溶液中加几滴 KSCN 作指示剂,用 c mol/L 的 NH4Fe(SO4)2 标准溶液滴定至溶液显红色,消耗标准溶液的体积为 V mL。
①滴定时发生反应的离子方程式是_____;
②样品中钛的含量为_____%(用含 w、c、V 的式子表示)。
-
我国是世界上较早冶炼锌的国家。在现代工业中,锌更是在电池制造、合金生产等领域有着广泛的用途。
已知:锌的熔点为419.6℃,沸点907℃。
I.图是古代以炉甘石(ZnCO3)为原料炼锌的示意图。
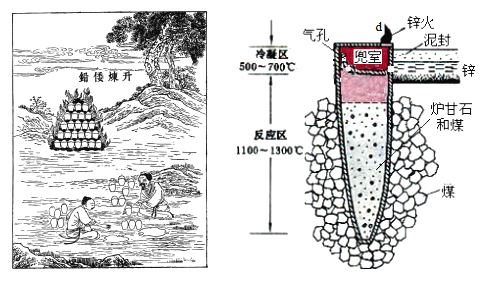
(1)泥罐内的主要反应为:
i.ZnCO3(s) = ZnO(s) + CO2(g) H1
ii.CO2(g) + C(s) = 2CO(g) H 2
……
总反应:ZnCO3(s) + 2C(s) = Zn(g) + 3CO(g) H3
利用H1和H 2计算时H3,还需要利用_________反应的H。
(2)泥罐中,金属锌的状态变化是_____;d口出去的物质主要是_______。
Ⅱ.现代冶炼锌主要采取湿法工艺。以闪锌矿(主要成分为ZnS,还含铁等元素)、软锰矿(主要成分为MnO2,还含铁等元素)为原料联合生产锌和高纯度二氧化锰的一种工艺的主要流程如下:
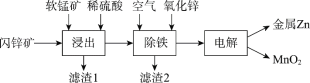
(3)浸出:加入FeSO4能促进ZnS的溶解,提高锌的浸出率,同时生成硫单质。Fe2+的作用类似催化剂,“催化”过程可表示为:
ⅰ:MnO2+2Fe2++4H+ =Mn2++2Fe3++2H2O
ⅱ:……
① 写出ⅱ的离子方程式:_________。
② 下列实验方案可证实上述“催化”过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量MnO2,溶液变红。
b.________。
(4)除铁:已知①进入除铁工艺的溶液的pH约为3;②控制溶液pH为2.5~3.5,使铁主要以FeOOH沉淀的形式除去。结合离子方程式说明,通入空气需同时补充适量ZnO的理由是_________。
(5)电【解析】
用惰性电极电解时,阳极的电极反应是______。
(6)电解后的溶液中可循环利用的物质是___________。
-
(本题共12分)铜是生命必需的元素,也是人类广泛使用的金属。
28.现代工业上,主要采用高温冶炼黄铜矿(CuFeS2,也可表示为Cu2S•Fe2S3)的方法获得铜。火法炼铜首先要焙烧黄铜矿:2CuFeS2+4O2 Cu2S+3SO2+2FeO,反应中被还原的元素有 ,每转移0.6mol电子,有 mol硫被氧化。产物中的SO2是一种大气污染物,可选用下列试剂中的 吸收(选填编号)。
Cu2S+3SO2+2FeO,反应中被还原的元素有 ,每转移0.6mol电子,有 mol硫被氧化。产物中的SO2是一种大气污染物,可选用下列试剂中的 吸收(选填编号)。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.CaCl2
29.Cu2O投入足量的某浓度的硝酸中,若所得气体产物为NO和NO2的混合物,且体积比为1﹕1,发生反应的化学方程式为: 。
30.某同学通过电化学原理实现了如下转化:Cu+2H+→Cu2++H2↑,则H2在 极获得(填写电极名称)。
31.向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式 。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释 。
32.将SO2气体通入CuCl2溶液中,生成CuCl沉淀的同时,还有产物 (填写化学式)。
-
(1)铜是生命必需的元素,也是人类广泛使用的金属。现代工业上,主要采用高温冶炼黄铜矿(CuFeS2,也可表示为Cu2S•Fe2S3)的方法获得铜。火法炼铜首先要焙烧黄铜矿:2CuFeS2+4O2 Cu2S+3SO2+2FeO,反应中被还原的元素有_________,每转移0.6mol电子,有_________mol硫被氧化。
Cu2S+3SO2+2FeO,反应中被还原的元素有_________,每转移0.6mol电子,有_________mol硫被氧化。
(2)产物中的SO2是一种大气污染物,可选用下列试剂中的_________吸收(选填编号)。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.CaCl2
(3)Cu2O投入足量的某浓度的硝酸中,若所得气体产物为NO和NO2的混合物,且体积比为1﹕1,发生反应的化学方程式为:____________________________________。
(4)某同学通过电化学原理实现了如下转化:Cu+2H+→Cu2++H2↑,则H2在_________极获得(填写电极名称)。
(5)向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式 _________。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释______。
(6)将SO2气体通入CuCl2溶液中,生成CuCl沉淀的同时,还有产物_________(填写化学式)。
-
(6分)铜及其化合物在工业、农业、科技和日常生活中有广泛应用。
(1)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜。
为了测定辉铜矿样品的纯度,用酸性高锰酸钾溶液反应,请完成下列离子方程式:
Cu2S+ MnO4-+
MnO4-+ H+
H+
 Cu2++
Cu2++ SO42-+
SO42-+ Mn2++
Mn2++ H2O
H2O
(2)现有一块含有铜绿[Cu2(OH)2CO3]
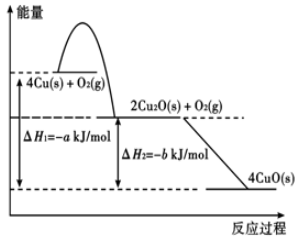
的铜片(假设不含其它杂质)在空气中灼烧至完全反应,经测定,反应前后固体的质量相同。①固态铜与适量氧气反应,能量变化如图所示,写出固态铜与氧气反应生成1 mol固态氧化亚铜的热化学方程式
②上述铜片中铜的生锈率为
-
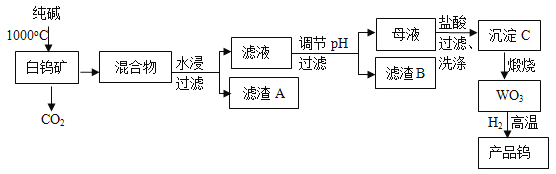
我国是世界上最大的钨储藏国,金属钨可用于制造灯丝、合金钢和光学仪器,有“光明使者”的美誉;现以白钨矿(主要成分为CaWO4,还含有二氧化硅、氧化铁等杂质)为原料冶炼高纯度金属钨,工业流程如下:
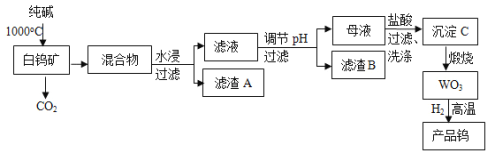
已知:①钨酸酸性很弱,难溶于水;
②完全沉淀离子的pH值:SiO32-为8,WO42-为5;
③碳和金属钨在高温下会反应生成碳化钨。
回答下列问题:
(1)工业上生产纯碱常先制得碳酸氢钠,此法叫“联碱法”,为我国化工专家侯德榜创立,即向饱和食盐水中先通入NH3,再通入CO2,最终生成碳酸氢钠晶体和氯化铵溶液,写出该化学反应方程式:____________。
(2)流程中白钨矿CaWO4和纯碱发生的化学反应方程式是:________________________。
(3)滤渣B的主要成分是(写化学式)______。调节pH可选用的试剂是:_____(填选项)。
A.氨水 B.盐酸 C.NaOH溶液 D.Na2CO3溶液
(4)检验沉淀C是否洗涤干净的操作是________________________________________。
(5)为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂的原因是_________。
(6)将氢氧化钙加入钨酸钠碱性溶液中可得到钨酸钙,已知某温度时,Ksp(CaWO4)=1×10-10,Ksp[Ca(OH)2]=4×10-7,当溶液中WO42-恰好沉淀完全(离子浓度等于10-5mol/L)时,溶液中c(OH-)=_____。
-
我国是世界上最大的钨储藏国,金属钨可用于制造灯丝、合金钢和光学仪器,有“光明使者”的美誉,现以白钨矿(主要成分为CaWO4,还含有二氧化硅、氧化铁等杂质)为原料冶炼高纯度金属钨,工业流程如图:
已知:①钨酸酸性很弱,难溶于水;
②完全沉淀离子的pH值:SiO32﹣为8,WO42﹣为5;
③碳和金属钨在高温下会反应生成碳化钨。
回答下列问题:
(1)工业上生产纯碱常先制得碳酸氢钠,此法叫“联碱法”,为我国化工专家侯德榜创立,即向饱和食盐水中先通入NH3,再通入CO2,最终生成碳酸氢钠晶体和氯化铵溶液,写出该化学反应方程式:____。
(2)流程中白钨矿CaWO4和纯碱发生的化学反应方程式是:____。
(3)滤渣B的主要成分是(写化学式)___。调节pH可选用的试剂是:__(填选项)。
A.氨水 B.盐酸 C.NaOH溶液 D.Na2CO3溶液
(4)检验沉淀C已经洗涤干净的操作是____。
(5)为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂的原因是:___。
(6)将氢氧化钙加入钨酸钠碱性溶液中可得到钨酸钙,已知某温度时,Ksp(CaWO4)=1×10﹣10,Ksp[Ca(OH)2]=4×10﹣7,当溶液中WO42﹣恰好沉淀完全(离子浓度等于10﹣5mol/L)时,溶液中c(OH﹣)=____。
)。若生产含Cu量为97.5%的粗铜48t,则生产SO2_________L(标准状况下);需要精辉铜矿_______t(保留一位小数)。
2Cu2O+ 2SO2、2Cu2O+ Cu2S
6Cu+ SO2↑