-
工业上生产硫酸的原料,一种是黄铁矿,其主要成分为FeS2(S为-1价);另一种是磁黄铁矿,其主要成分是Fe1-xS(S为-2价),式中x通常为0.1~0.2,既含有Fe2+又含有Fe3+。
生产硫酸时将矿石煅烧,发生反应如下:
① 4 FeS2+ 11 O2→ 2 Fe2O3+ 8 SO2
② 4 Fe1-xS + (7-3x) O2→ 2 (1-x) Fe2O3+ 4 SO2
(1)含FeS272%的黄铁矿10吨,理论上最多可以生产98%的浓硫酸___________吨(矿石中无其他含硫物质)。
(2)若磁黄铁矿Fe1-xS中x=0.1,则Fe1-xS中Fe2+与Fe3+的物质的量之比为_____:1。
(3)煅烧矿石时,为了尽可能地将矿石中的硫转变为SO2,需通入过量20%的空气(其中N2与O2的体积比为4:1,假设无其他气体成分),计算磁黄铁矿充分煅烧后排出的气体中SO2的体积分数_____(用含x的代数式表示)。
(4)将一定量的磁黄铁矿溶于足量的盐酸,充分反应后测得生成S单质2.4g,FeCl20.425mol,且溶液中无Fe3+,计算Fe1-xS中的x_____值(矿石中其他成分不与盐酸反应)。
高三化学计算题困难题查看答案及解析
-
工业上生产硫酸的原料,一种是黄铁矿,其主要成分为FeS2(S为-1价);另一种是磁黄铁矿,其主要成分是Fe1-xS(S为-2价),式中x通常为0.1~0.2,既含有Fe2+又含有Fe3+。
生产硫酸时将矿石煅烧,发生反应如下:
① 4 FeS2 + 11 O2 → 2 Fe2O3 + 8 SO2
② 4 Fe1-xS + (7-3x) O2 → 2 (1-x) Fe2O3 + 4 SO2
(1)含FeS2 72%的黄铁矿10吨,理论上最多可以生产98%的浓硫酸________吨(矿石中无其他含硫物质)。
(2)若磁黄铁矿Fe1-xS中x=0.1,则Fe1-xS中Fe2+与Fe3+的物质的量之比为________:1。
(3)煅烧矿石时,为了尽可能地将矿石中的硫转变为SO2,需通入过量20%的空气(其中N2与O2的体积比为4:1,假设无其他气体成分),计算磁黄铁矿充分煅烧后排出的气体中SO2的体积分数(用含x的代数式表示)。
(4)将一定量的磁黄铁矿溶于足量的盐酸,充分反应后测得生成S单质2.4g,FeCl2 0.425mol,且溶液中无Fe3+,计算Fe1-xS中的x值(矿石中其他成分不与盐酸反应)。
高三化学计算题困难题查看答案及解析
-
工业上生产硫酸的原料,一种是黄铁矿,其主要成分为FeS2(S为-1价);另一种是磁黄铁矿,其主要成分是Fe1-xS(S为-2价),式中x通常为0.1~0.2,既含有Fe2+又含有Fe3+。
生产硫酸时将矿石煅烧,发生反应如下:
① 4 FeS2 + 11 O2→ 2 Fe2O3 + 8 SO2
② 4 Fe1-xS + (7-3x) O2→ 2 (1-x) Fe2O3 + 4 SO2
含FeS272%的黄铁矿10吨,理论上最多可以生产98%的浓硫酸________吨(矿石中无其他含硫物质)。
若磁黄铁矿Fe1-xS中x=0.1,则Fe1-xS中Fe2+与Fe3+的物质的量之比为________:1。
煅烧矿石时,为了尽可能地将矿石中的硫转变为SO2,需通入过量20%的空气(其中N2与O2的体积比为4:1,假设无其他气体成分),计算磁黄铁矿充分煅烧后排出的气体中SO2的体积分数(用含x的代数式表示)。
高三化学计算题困难题查看答案及解析
-
工业上生产下列物质,不涉及氧化还原反应的是
A.用铝矾土(主要成分Al2O3)生产金属铝
B.用硫铁矿(主要成分FeS2)生产硫酸
C.用海水、贝壳生产氯化镁晶体
D.用氯化钠生产烧碱
高三化学选择题中等难度题查看答案及解析
-
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要 成分为FeS2)进行硫元素含量测定的实验探究及工业生产硫酸的探究。
I .将m1,g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置 省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2 + 11O2
2Fe2O3 + 8SO2
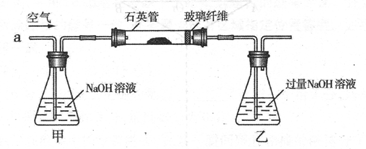
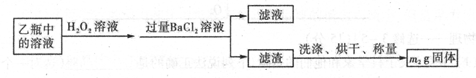
II反应结束后,将乙瓶中的溶液进行如下处理
(1)I中,乙瓶内发生反应的离子方程式有____________、__________。
(2)II中,所加H2O2溶液需足量的理由是____________________________
(3)该黄铁矿石中硫元素的质量分数为____________________________
(4)简述在催化反应室中设置热交换器的目的:______________。
(5)工业生产中常用氨——硫酸法进行尾气脱硫,以达到消除污染、废物利用的目的,用 两个化学方程式表示其反应原理_______________、______________
高三化学实验题中等难度题查看答案及解析
-
(13分)氯化铁是一种重要的化学试剂和化工原料,工业上以黄铁矿(主要成分为FeS2)为原料在制备硫酸的同时,利用其煅烧后炉渣的主要成分Fe2O3可制备氯化铁晶体(FeCl3·6H2O),其工艺流程如下(杂质不参与反应):
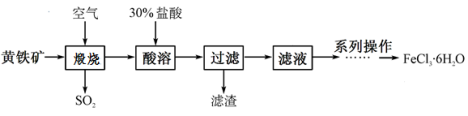
回答下列问题:
(1)高温煅烧时,黄铁矿要粉碎成细小的颗粒,其目的是 。
(2)黄铁矿高温煅烧时发生反应的化学方程式 。
(3)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(4)系列操作包括:蒸发浓缩、 、 、洗涤等。蒸发与过滤时玻璃棒的作用分别是: 、 。
(5)取a g黄铁矿,按上述流程制得FeCl3·6H2O晶体,将该晶体溶于水,再将所得溶液蒸干、灼烧,得到b g固体产物(整个过程中的损耗忽略不计),黄铁矿的纯度为 (用含a、b的表达式表示)。
高三化学实验题困难题查看答案及解析
-
从古至今,铁及其化合物在人类生产、生活中的作用发生了巨大的变化。
(1)现代工业“接触法制硫酸”用黄铁矿(主要成分为FeS2)为原料。测得硫酸渣的化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):
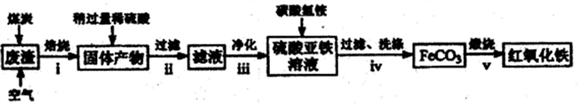
请回答下列问题:
①在步骤i中产生的有毒气体可能有___________________。
②在步骤iii操作中,要除去的离子之一为Al3+,若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上将Al3+沉淀完全,则溶液的pH为_________(注:c(Al3+)≤10-5mol·L-1视为沉淀完全)。
③步骤ⅳ中,洗涤沉淀的操作是___________________。
生成FeCO3的离子方程式是__________________。
(2)氯化铁溶液称为化学试剂中的“多面手”,向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式_____________。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:______________________。
(3)古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ⅱ的离子方程式是________________________________________。
高三化学简答题中等难度题查看答案及解析
-
(16分)黄铁矿是工业上制取硫酸的主要原料,其主要成分为FeS2,含少量杂质(杂质不含S元素,且高温下不反应)。某化学兴趣小组用下列装置测定黄铁矿中硫元素的质量分数。
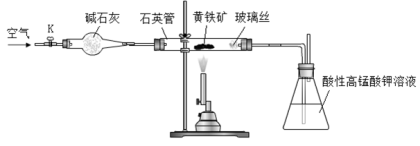
称取2.0g研细的黄铁矿样品,将样品放入石英管中,缓慢鼓入空气,再加热石英管至800~850℃;锥形瓶中盛装100 mL 0.2mol/L酸性KMnO4溶液用于吸收SO2(忽略SO2、H2SO3与氧气反应);反应结束后,每次从锥形瓶中取出25.00 mL溶液,用0.23mol/L标准H2C2O4溶液滴定,重复三次。
已知:4FeS2+11O2
2Fe2O3+8SO2;2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4
请回答下列问题:
(1)连接好装置,检查装置气密性的操作是 。
(2)通入空气的作用是 。
(3)若实验过程中鼓入空气的速率过快,则测得的硫元素的质量分数 。(填“偏高”、“偏低”或“不变”)
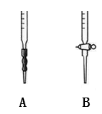
(4)滴定时,应选择下图中的 (填字母序号)盛装标准H2C2O4溶液,根据 现象来判断滴定已经达到终点。
(5)滴定过程中发生反应的离子方程式是 。
(6)如果黄铁矿中的硫全部转化为SO2,且被酸性KMnO4溶液完全吸收,滴定操作中,平均耗用0.23mol/L标准H2C2O4溶液21.73mL,则黄铁矿样品中硫元素的质量分数是 。(保留到小数点后1位)
高三化学实验题极难题查看答案及解析
-
黄铁矿是工业上制取硫酸的主要原料,其主要成分为FeS2,含少量杂质(杂质不含S元素,且高温下不反应)。某化学兴趣小组用下列装置测定黄铁矿中硫元素的质量分数。
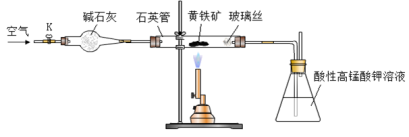
称取2.0g研细的黄铁矿样品,将样品放入石英管中,缓慢鼓入空气,再加热石英管至800~850℃;锥形瓶中盛装100 mL 0.2mol/L酸性KMnO4溶液用于吸收SO2(忽略SO2、H2SO3与氧气反应);反应结束后,每次从锥形瓶中取出25.00 mL溶液,用0.23mol/L标准H2C2O4溶液滴定,重复三次。
已知:4FeS2+11O2
2Fe2O3+8SO2;
2KMnO4+5SO2+2H2O
K2SO4+2MnSO4+2H2SO4
请回答下列问题:
(1)连接好装置,检查装置气密性的操作是 。
(2)通入空气的作用是 。
(3)若实验过程中鼓入空气的速率过快,则测得的硫元素的质量分数 (填“偏高”、“偏低”或“不变”)。
(4)滴定时,应选择图中的 (填字母序号)盛装标准H2C2O4溶液,根据 现象来判断滴定已经达到终点。

(5)滴定过程中发生反应的离子方程式是 。
(6)如果黄铁矿中的硫全部转化为SO2,且被酸性KMnO4溶液完全吸收,滴定操作中,平均耗用0.23mol/L标准H2C2O4溶液21.73mL,则黄铁矿样品中硫元素的质量分数是 (保留到小数点后1位)。
高三化学实验题极难题查看答案及解析
-
黄铁矿是工业上制取硫酸的主要原料,其主要成分为FeS2,含少量杂质(杂质不含S元素,且高温下不反应).某化学兴趣小组用下列装置测定黄铁矿中硫元素的质量分数.
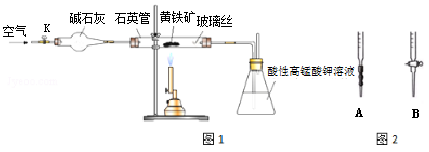
称取2.0g研细的黄铁矿样品,将样品放入石英管中,缓慢鼓入空气,再加热石英管至800~850℃;锥形瓶中盛装100mL 0.2mol/L酸性KMnO4溶液用于吸收SO2(忽略SO2、H2SO3与氧气反应);反应结束后,每次从锥形瓶中取出25.00mL溶液,用0.23mol/L标准H2C2O4溶液滴定,重复三次.已知:4FeS2+11O2
2Fe2O3+8SO2;2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4请回答下列问题:
(1)连接好装置,检查装置气密性的操作是___________________
(2)通入空气的作用是_________________________.
(3)若实验过程中鼓入空气的速率过快,则测得的硫元素的质量分数__________.(填“偏高”、“偏低”或“不变”)
(4)滴定时,应选择右图中的_________(填字母序号)盛装标准H2C2O4溶液,根据_____________现象来判断滴定已经达到终点.
(5)如果黄铁矿中的硫全部转化为SO2,且被酸性KMnO4溶液完全吸收,滴定操作中,平均耗用0.23mol/L标准H2C2O4溶液21.73mL,则黄铁矿样品中硫元素的质量分数是____________.(保留到小数点后1位)
高三化学实验题困难题查看答案及解析