-
化学反应原理在科研和生产中有广泛应用.
(1)工业上制取Ti的步骤之一是:在高温时,将金红石(TiO2)、炭粉混合并通人Cl2先制得TiCl4和一种可燃性气体,已知:
①TiO2(s)+2Cl2(g)═TiCl4(1)+O2(g);△H=﹣410.0kJ•mol﹣1
②CO(g)═C(s)+ O2(g);△H=+110.5kJ•mol﹣1
O2(g);△H=+110.5kJ•mol﹣1
则上述反应的热化学方程式是 .
(2)利用“化学蒸气转移法”制备二硫化钽(TaS2)晶体,发生如下反应:
TaS2(s)+2I2(g)═TaI4(g)+S2(g)△H1>0 (Ⅰ);若反应(Ⅰ)的平衡常数K=1,向某恒容且体积为15ml的密闭容器中加入1mol I2 (g)和足量TaS2(s),I2 (g)的平衡转化率为 .
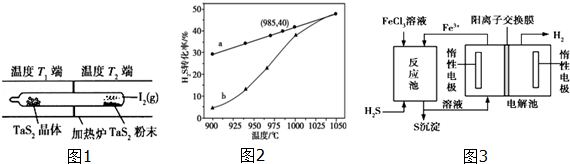
如图1所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2 (g),一段时间后,在温度为T1的一端得到了纯净TaS2晶体,则温度T1 T2(填“>”“<”或“=”).上述反应体系中循环使用的物质是 .
(3)利用H2S废气制取氢气的方法有多种.
①高温热分解法:
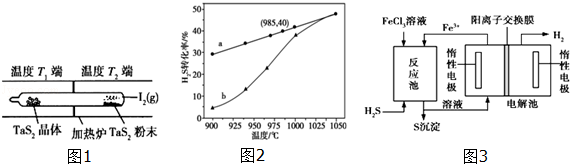
已知:H2S(g)═H2(g)+ S2(g);△H2;在恒容密闭容器中,控制不同温度进行H2S分解实验.以H2S起始浓度均为c mol•L﹣1测定H2S的转化率,结果如图2.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.△H2 0(填>,=或<);说明随温度的升高,曲线b向曲线a逼近的原因: .
S2(g);△H2;在恒容密闭容器中,控制不同温度进行H2S分解实验.以H2S起始浓度均为c mol•L﹣1测定H2S的转化率,结果如图2.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.△H2 0(填>,=或<);说明随温度的升高,曲线b向曲线a逼近的原因: .
②电化学法:
该法制氢过程的示意图如3.反应后的溶液进入电解池,电解总反应的离子方程式为 .
-
化学反应原理在科研和生产中有广泛应用.
(1)工业上制取Ti的步骤之一是:在高温时,将金红石(TiO2)、炭粉混合并通人Cl2先制得TiCl4和一种可燃性气体,已知:
①TiO2(s)+2Cl2(g)═TiCl4(1)+O2(g);△H=﹣410.0kJ•mol﹣1
②CO(g)═C(s)+ O2(g);△H=+110.5kJ•mol﹣1
O2(g);△H=+110.5kJ•mol﹣1
则上述反应的热化学方程式是 .
(2)利用“化学蒸气转移法”制备二硫化钽(TaS2)晶体,发生如下反应:
TaS2(s)+2I2(g)═TaI4(g)+S2(g)△H1>0 (Ⅰ);若反应(Ⅰ)的平衡常数K=1,向某恒容且体积为15ml的密闭容器中加入1mol I2 (g)和足量TaS2(s),I2 (g)的平衡转化率为 .
如图1所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2 (g),一段时间后,在温度为T1的一端得到了纯净TaS2晶体,则温度T1 T2(填“>”“<”或“=”).上述反应体系中循环使用的物质是 .
(3)利用H2S废气制取氢气的方法有多种.
①高温热分解法:
已知:H2S(g)═H2(g)+ S2(g);△H2;在恒容密闭容器中,控制不同温度进行H2S分解实验.以H2S起始浓度均为c mol•L﹣1测定H2S的转化率,结果如图2.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.△H2 0(填>,=或<);说明随温度的升高,曲线b向曲线a逼近的原因: .
S2(g);△H2;在恒容密闭容器中,控制不同温度进行H2S分解实验.以H2S起始浓度均为c mol•L﹣1测定H2S的转化率,结果如图2.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.△H2 0(填>,=或<);说明随温度的升高,曲线b向曲线a逼近的原因: .
②电化学法:
该法制氢过程的示意图如3.反应后的溶液进入电解池,电解总反应的离子方程式为 .
-
短周期主族元素W、X、Y、Z的原子序数依次增大。工业上以金红石(主要成分是TiO2)为原料制备金属钛的步骤:①在高温下,向金红石与W的单质的混合物中通入Z的气体单质,得到化合物甲和化学式为WX的常见可燃性有毒气体乙,乙燃烧火焰呈蓝色;②在稀有气体环境和加热条件下,用Y的金属单质与甲反应可得钛,下列说法不正确的是( )
A.非金属性:Z>X>W B.W与Z形成的化合物可用于工业上的重要有机溶剂
C.简单离子半径:Z>X>Y D.ZX2具有强氧化性,可用于饮用水消毒
-
短周期主族元素W、X、Y、Z的原子序数依次增大。工业上以金红石(主要成分是TiO2)为原料制备金属钛的步骤:①在高温下,向金红石与W的单质的混合物中通入Z的气体单质,得到化合物甲和化学式为WX的常见可燃性气体乙;②在稀有气体环境和加热条件下,用Y的金属单质与甲反应可得钛,下列说法不正确的是
A. 非金属性:Z>X>W
B. 简单离子半径:Z>X>Y
C. W与Z形成的化合物可用于工业上的重要有机溶剂
D. ZX2具有强氧化性,可用于饮用水消毒
-
(12分)
钠米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备是:
I.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应制得混有SiCl4杂质的TiCl4。
II.将SiCl4分离,得到纯净的TiCl4。
III.在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
IV.TiO2·Xh2O高温分解得到TiO2。
①TiCl4与SiCl4在常温下的状态是________。II中所采取的操作名称是________。
②III中反应的化学方程式是________。
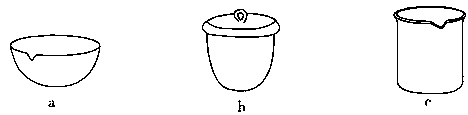
③如IV在实验室完成,应将TiO2·xH2O放在________(填仪器编号)中加热。
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O,其过程大致如下:
a. O2→2O b. O2+H2O→2OH(羟基) c. OH+OH→H2O2
①b中破坏的是________(填“极性共价键”或“非极性共价键”)。
②H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的________(填“氧化性”或“还原性”)。
(3)某研究小组用下列装置模拟“生态马路”部分原理。(夹持装置已略去)
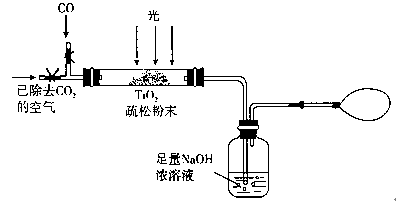
①如缓通入22.4L(已折算成标准状况)CO气体,结果NaOH溶液增重11g,则CO的转化率为________。
②当CO气体全部通入后,还要通一会儿空气,其目的是________。
-
纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备方法是:
Ⅰ.将干燥后的金红石(主要成分是TiO2,主要杂质是SiO2)与碳粉混合放入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
Ⅱ.将SiCI4分离,得到纯净的TiCl4。
Ⅲ.在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
Ⅳ.TiO2·xH2O高温分解得到TiO2。

①根据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是________,分离二者所采用的操作名称是________。
②Ⅲ中反应的化学方程式是________。
③如Ⅳ在实验室中完成,应将TiO2·xH2O放在________(填字母)中加热。

(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2。H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的________ (填“氧化性”或“还原性”)。
(3)某研究小组用下列装置模拟“生态马路”的部分原理。(夹持装置已略去)

①如缓慢通入22.4 L(已折算成标准状况)CO气体,结果NaOH溶液增重11 g,则CO的转化率为________。
②当CO气体全部通入后,还要按图示通一段时间空气,其目的是________。
-
纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备方法是:
Ⅰ.将干燥后的金红石(主要成分是TiO2,主要杂质是SiO2)与碳粉混合放入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4.
Ⅱ.将SiCl4分离,得到纯净的TiCl4.
Ⅲ.向TiCl4中加水,加热,水解得到沉淀TiO2•xH2O.
Ⅳ.将TiO2•xH2O高温分解得到TiO2.
| 资料卡片 |
| 物质 | 熔点 | 沸点 |
| SiCl4 | -70℃ | 57.6℃ |
| TiCl4 | -25℃ | 136.5℃ |
| | |
①据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是_____;分离二者所采取的操作名称是____。
②Ⅲ中反应的化学方程式是________。
③如在实验室中完成步骤IV,应将TiO2•xH2O放在_____(填字母序号图 1)中加热。

(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或 水中的氧获得,生成H2O2.H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的__________(填“氧化性”或“还原性”)。
(3)图2是某研究小组用下列装置模拟“生态马路”的部分原理(夹持装置已略去).
①缓慢通入22.4L(已折算成标准状况)CO气体和足量空气,最终测得NaOH溶液增重11g,则CO 的转化率为________。
②实验①中,当CO气体全部通入后,还要再通一会儿空气,其目的是________。
-
钠米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂.
(1)工业上二氧化钛的制备是:
I.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应制得混有SiCl4杂质的TiCl4.
II.将SiCl4分离,得到纯净的TiCl4.
III.在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O.
IV.TiO2•Xh2O高温分解得到TiO2.

①TiCl4与SiCl4在常温下的状态是______.II中所采取的操作名称是______.
②III中反应的化学方程式是______ TiO2•xH2O↓+4HCl
-
氧化铝在工业上有着广泛的应用。(写出计算过程)
(1)制取净水剂氯化铝。其原理为:Al2O3+3C+3Cl2 2AlCl3+3CO。25.5g 氧化铝、3.6g 碳、4.48L(标准状态)氯气混合后在高温下反应,理论上可得氯化铝_____克。
2AlCl3+3CO。25.5g 氧化铝、3.6g 碳、4.48L(标准状态)氯气混合后在高温下反应,理论上可得氯化铝_____克。
(2)向100g氢氧化钠溶液中加入10g 氧化铝,充分反应后,剩余固体4.9克。测得所得溶液的密度为1.051g/cm3 。则所得溶液的物质的量浓度为______________。
(3)超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:Al2O3+N2+3C 2AlN+3CO。由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。
2AlN+3CO。由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。
① 取一定量样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g·L-1(已折算成标准状况,AIN不跟O2反应)。该样品中含杂质炭__________g。
② 向①中反应后的容器中加入过量的NaOH浓溶液共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,得到氨气3.36L(标准状况)及16.38g的固体。再将该固体配成溶液,向其中慢慢加入1mol/L盐酸,当加到20mL时开始产生沉淀。求该样品中的AlN的质量分数为________。(用小数表示,保留2位小数)
(4)用氧化铝为原料可制得含铝化合物X。取6.9gX放入100mL水中完全溶解,溶液呈弱酸性。取出10mL加入过量盐酸,无气泡,再加入过量氯化钡有白色沉淀0.932g 。另取10mL样品,慢慢滴加氢氧化钠溶液直至过量,过程中出现的现象为出现白色沉淀→沉淀逐渐增多→沉淀不再变化→沉淀开始减少→沉淀全部消失。若改用氨水做上述实验最终可得0.156g沉淀。经测定X中含氢量为4.64% 。求化合物X的化学式_______。
-
化学反应原理在科研和生产中有广泛应用,根据题意回答下列问题:
I工业上制备Na2S的反应原理如下
①Na2SO4(s)===Na2S(s)+2O2(g) △H1=+1011.0kJ·mol-1
②C(s)+O2(g)===CO2(g) △H2=-393.5kJ·mol-1
③2C(s)+O2(g)===2CO(g) △H3=-221.0kJ·mol-1
④Na2SO4(s)+4C(s)===Na2S(s)+4CO(g) △H4
(1)△H4=___________ kJ·mol-1。
(2)反应④能自发进行的条件是___________。
(3)工业上制备Na2S不用反应①,而用反应④的理由是_____________________________。
Ⅱ.在一定温度下,向某恒容密闭容器中充入等物质的量的NO和CO发生反应:2NO(g)+2C0(g)  2CO2(g)+N2(B) △H=-748kJ/mo1。用气体传感器测得不同时间NO的浓度如下:
2CO2(g)+N2(B) △H=-748kJ/mo1。用气体传感器测得不同时间NO的浓度如下:
| 时间(s) | 0 | 10 | 20 | 30 | 40 | …… |
| C(NO)/mol/L | 0.100 | 0.050 | 0.025 | 0.010 | 0.010 | …… |
(1)计算此温度下该反应的K=______________________。
(2)达到平衡时,下列措施能提高NO转化率的是___________(填序号)。
A.选用更有效的催化剂
B.降低反应体系的温度
C.充入氩气使容器内压强增大
D.充入CO使容器内压强增大
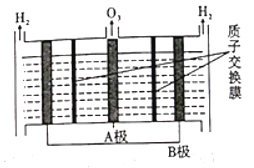
Ⅲ.工业上常用臭氧处理含NO2-的废水。
(1)O3氧化NO2-可产生NO3-和O2,反应中每生成1mol的O2转移___________mol电子。
(2)O3可由电解稀硝酸制得,原理如图。图中阴极为___________(填“A”或“B”),阳极(惰性电极)的电极反应式为____________________________________________。
O2(g);△H=+110.5kJ•mol﹣1

S2(g);△H2;在恒容密闭容器中,控制不同温度进行H2S分解实验.以H2S起始浓度均为c mol•L﹣1测定H2S的转化率,结果如图2.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.△H2 0(填>,=或<);说明随温度的升高,曲线b向曲线a逼近的原因: .







