-
氨气在产生、生活中都有广泛用途,所以,化学学习中对氨气认识十分重要。
(1)已知H-H键、N-H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol,合成氨的热化学方程式为_____________。
(2)下列方法可以证明 N2(g)+3H2(g) 2NH3(g)已达平衡状态的是____。
2NH3(g)已达平衡状态的是____。
①单位时间内生成n mol H2同时生成n molNH3
②单位时间内3molH—H键断裂同时有6 mol H—N键断裂
③温度和体积一定时,容器内压强不再变化
④c(N2)︰c(H2)︰c(NH3)=1︰3︰2
⑤反应速率2v(H2)= 3v(NH3)
⑥条件一定,混合气体的平均相对分子质量不再变化
⑦温度和体积一定时,混合气体的密度不再变化
(3) 25 ℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0 mL,测得pH=11,则该条件下,NH3•H2O的电离平衡常数约为__________。向此溶液中加入少量的氯化铵固体时,[c(NH3•H2O) • c(H+)] / c(NH4+)值将______(“增大”“减小”或“不变”)。
(4)若向该氨水中逐滴加入等浓度的盐酸,溶液中pH与pOH(pOH=-lg[OH-])的变化关系如图所示。
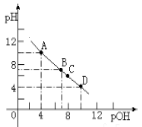
B点所加盐酸的体积_____(填“>”、“=”或“<”) 20.0 mL。C点溶液中离子浓度大小顺序为_____>____>_____>_____。
(5)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当pH=_________时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33)。
-
氨气是一种重要的化工产品,有广泛用途,工业上可以由氢气和氮气合成。
(1)已知键能:N N 945kJ·mol-1,H-H 436 kJ·mol-1,N-H 391kJ·mol-1。
N 945kJ·mol-1,H-H 436 kJ·mol-1,N-H 391kJ·mol-1。
①氮气、氢气合成氨的热化学方程式是______________。
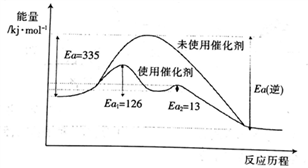
②未使用催化剂时,逆反应的活化能Ea(逆)=______ kJ·mol-1;使用催化剂之后正反应的总活化能为_______ kJ·mol-1。
(2)下表是当反应器中按n(N2):n(H2)=l:3投料后,在200℃、400℃、600℃,反应达到平衡时,混合物中NH3的物质的量分数随总压强的变化曲线。
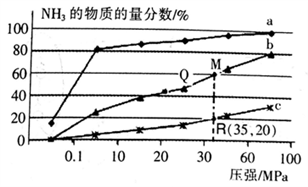
①曲线a、b对应温度较高的是________ (填“a”或“b”)
②实验室模拟工业合成氨,一定温度和压强下在1L密闭容器中通入5 mol N2、15molH2,10min 后达到M点平衡状态,计算从反应开始至平衡时间段内的平均速率V(N2)___mol·L-1·min-1。
③关于工业合成氨的反应,下列叙述正确的是_______(填字母)。
A.分离出NH3后的原料气循环利用,可以提高H2的平衡转化率
B.使州催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、Q、R点平衡常数K的大小关系是K(M)= K(Q)> K(R)
④列出R点平衡常数的计算式Kp=____(MPa)-2。(用平衡分压代替平衡浓度计箅,分压=总压×物质的量分数。不要求计算结果)
-
氨气是一种重要化工原料。
(1)德国化学家哈伯从1902年开始研究由氮气和氢气直接合成氨。
已知:①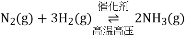 △H=a kJ/mol
△H=a kJ/mol
②每破坏lmol有关化学键需要的能量如下表:
| H-H | N-H | N≡N |
| 436kJ | 391kJ | 946k |
则a=_________________。
(2)下图为不同温度(T)、不同投料比[n( )/n(
)/n( )]时反应达到平衡时
)]时反应达到平衡时 的转化率变化曲线。
的转化率变化曲线。

① 、
、 、
、 、
、 的大小关系为__________________。
的大小关系为__________________。
②保持温度和体积不变,提高投料比[n( )/n(
)/n( )],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
)],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
A. 的浓度增大
的浓度增大
B. 的转化率增大
的转化率增大
C. 的体积分数增大
的体积分数增大
D. 的浓度减小
的浓度减小
③温度为 时,向2L密闭容器中加入1.0mol
时,向2L密闭容器中加入1.0mol 和1.0mol
和1.0mol ,若5min后反应达到平衡,则用v(
,若5min后反应达到平衡,则用v( )表示该反应的平均速率为____________________;反应在
)表示该反应的平均速率为____________________;反应在 时的平衡常数K=________________。
时的平衡常数K=________________。
(3)一种新型除烟气中氮氧化物的方法是采用 作还原剂还原烟气中的氮氧化物且产物无污染,写出
作还原剂还原烟气中的氮氧化物且产物无污染,写出 还原
还原 的化学反应方程式_____________________________________。
的化学反应方程式_____________________________________。
(4)若用标准盐酸测定某稀氨水的浓度,应选择__________作指示剂;滴定过程中眼睛注视_____________。已知稀氨水体积为25.0mL,滴定结束测得消耗0.0100mol/L盐酸的平均体积为20.0mL,则该氨水的浓度为________________(保留2位有效数字);若滴定前滴定管尖嘴有气泡,滴定后尖嘴无气泡,则测定结果________(填“偏大”、“偏小”、“不变”)。
-
氨气是一种重要化工原料。
(1)德国化学家哈伯从1902年开始研究由氮气和氢气直接合成氨。
已知:① △H=a kJ/mol
△H=a kJ/mol
②每破坏lmol有关化学键需要的能量如下表:
| H-H | N-H | N≡N |
| 436kJ | 391kJ | 946k |
则a=_________________。
(2)下图为不同温度(T)、不同投料比[n( )/n(
)/n( )]时反应达到平衡时
)]时反应达到平衡时 的转化率变化曲线。
的转化率变化曲线。
① 、
、 、
、 、
、 的大小关系为__________________。
的大小关系为__________________。
②保持温度和体积不变,提高投料比[n( )/n(
)/n( )],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
)],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
A. 的浓度增大
的浓度增大
B. 的转化率增大
的转化率增大
C. 的体积分数增大
的体积分数增大
D. 的浓度减小
的浓度减小
③温度为 时,向2L密闭容器中加入1.0mol
时,向2L密闭容器中加入1.0mol 和1.0mol
和1.0mol ,若5min后反应达到平衡,则用v(
,若5min后反应达到平衡,则用v( )表示该反应的平均速率为____________________;反应在
)表示该反应的平均速率为____________________;反应在 时的平衡常数K=________________。
时的平衡常数K=________________。
(3)一种新型除烟气中氮氧化物的方法是采用 作还原剂还原烟气中的氮氧化物且产物无污染,写出
作还原剂还原烟气中的氮氧化物且产物无污染,写出 还原
还原 的化学反应方程式_____________________________________。
的化学反应方程式_____________________________________。
(4)若用标准盐酸测定某稀氨水的浓度,应选择__________作指示剂;滴定过程中眼睛注视_____________。已知稀氨水体积为25.0mL,滴定结束测得消耗0.0100mol/L盐酸的平均体积为20.0mL,则该氨水的浓度为________________(保留2位有效数字);若滴定前滴定管尖嘴有气泡,滴定后尖嘴无气泡,则测定结果________(填“偏大”、“偏小”、“不变”)。
-
氨气是一种重要化工原料。
(1)德国化学家哈伯从1902年开始研究由氮气和氢气直接合成氨。
已知:① △H=a kJ/mol
△H=a kJ/mol
②每破坏lmol有关化学键需要的能量如下表:
| H-H | N-H | N≡N |
| 436kJ | 391kJ | 946k |
则a=_________________。
(2)下图为不同温度(T)、不同投料比[n( )/n(
)/n( )]时反应达到平衡时
)]时反应达到平衡时 的转化率变化曲线。
的转化率变化曲线。
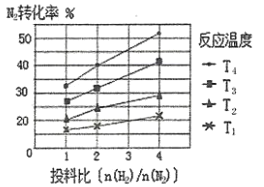
① 、
、 、
、 、
、 的大小关系为__________________。
的大小关系为__________________。
②保持温度和体积不变,提高投料比[n( )/n(
)/n( )],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
)],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
A. 的浓度增大
的浓度增大
B. 的转化率增大
的转化率增大
C. 的体积分数增大
的体积分数增大
D. 的浓度减小
的浓度减小
③温度为 时,向2L密闭容器中加入1.0mol
时,向2L密闭容器中加入1.0mol 和1.0mol
和1.0mol ,若5min后反应达到平衡,则用v(
,若5min后反应达到平衡,则用v( )表示该反应的平均速率为____________________;反应在
)表示该反应的平均速率为____________________;反应在 时的平衡常数K=________________。
时的平衡常数K=________________。
(3)一种新型除烟气中氮氧化物的方法是采用 作还原剂还原烟气中的氮氧化物且产物无污染,写出
作还原剂还原烟气中的氮氧化物且产物无污染,写出 还原
还原 的化学反应方程式_____________________________________。
的化学反应方程式_____________________________________。
(4)若用标准盐酸测定某稀氨水的浓度,应选择__________作指示剂;滴定过程中眼睛注视_____________。已知稀氨水体积为25.0mL,滴定结束测得消耗0.0100mol/L盐酸的平均体积为20.0mL,则该氨水的浓度为________________(保留2位有效数字);若滴定前滴定管尖嘴有气泡,滴定后尖嘴无气泡,则测定结果________(填“偏大”、“偏小”、“不变”)。
-
氨气是一种重要化工原料。
(1)德国化学家哈伯从1902年开始研究由氮气和氢气直接合成氨。
已知:① △H=a kJ/mol
△H=a kJ/mol
②每破坏lmol有关化学键需要的能量如下表:
| H-H | N-H | N≡N |
| 436kJ | 391kJ | 946k |
则a=_________________。
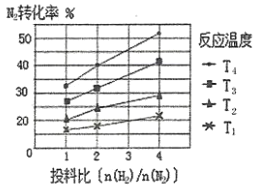
(2)下图为不同温度(T)、不同投料比[n( )/n(
)/n( )]时反应达到平衡时
)]时反应达到平衡时 的转化率变化曲线。
的转化率变化曲线。
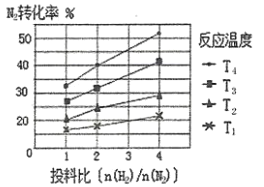
① 、
、 、
、 、
、 的大小关系为__________________。
的大小关系为__________________。
②保持温度和体积不变,提高投料比[n( )/n(
)/n( )],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
)],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
A. 的浓度增大
的浓度增大
B. 的转化率增大
的转化率增大
C. 的体积分数增大
的体积分数增大
D. 的浓度减小
的浓度减小
③温度为 时,向2L密闭容器中加入1.0mol
时,向2L密闭容器中加入1.0mol 和1.0mol
和1.0mol ,若5min后反应达到平衡,则用v(
,若5min后反应达到平衡,则用v( )表示该反应的平均速率为____________________;反应在
)表示该反应的平均速率为____________________;反应在 时的平衡常数K=________________。
时的平衡常数K=________________。
(3)一种新型除烟气中氮氧化物的方法是采用 作还原剂还原烟气中的氮氧化物且产物无污染,写出
作还原剂还原烟气中的氮氧化物且产物无污染,写出 还原
还原 的化学反应方程式_____________________________________。
的化学反应方程式_____________________________________。
(4)若用标准盐酸测定某稀氨水的浓度,应选择__________作指示剂;滴定过程中眼睛注视_____________。已知稀氨水体积为25.0mL,滴定结束测得消耗0.0100mol/L盐酸的平均体积为20.0mL,则该氨水的浓度为________________(保留2位有效数字);若滴定前滴定管尖嘴有气泡,滴定后尖嘴无气泡,则测定结果________(填“偏大”、“偏小”、“不变”)。
-
合成氨工业对国防具有重要意义,如制硝酸、合成纤维以及染料等
(1)已知某些化学键的键能数据如下表:
| 化学键 | N≡N | H—H | N—H |
| 键能kJ·mol-1 | 946 | 436 | 390 |
合成氨的热化学反应方程式为________。
(2)常温下,向饱和NaCl与饱和氨水的混合溶液中通入过量CO2,有NaHCO3固体析出,该反应的化学方程式为;所得溶液中离子的电荷守恒式是________;若向饱和NaCl与饱和CO2的混合溶液中通入氨气,则没有NaHCO3固体析出,原因是________。
(3)氨氮废水(含NH3、NaOH和Na2SO4)超标排放会造成水体富营养化。右图通过直接电化学氧化法有效除去某工厂氨气。其中阴离子的流动方向为________(填“向a极”或“向b极”),电解过程中,b极区的pH________(填“增大”或“减小”或“不变”),阳极反应方程式为。
-
氮及其化合物在生产生活中用途广泛。请回答:
I.在微生物作用下,土壤中的NH4+最终被O2氧化为NO3-,该反应的离子方程式为________。
Ⅱ.氨气是重要的化工原料。已知:25℃时,NH3·H2O的电离常数kb=1.79×10-5,该温度下,1.79mol/LNH4Cl溶液的pH约为_____________。
Ⅲ.汽车在行驶过程中有如下反应发生:
ⅰ.N2(g)+O2(g) 2NO(g) △H=+180.7kJ/mol
2NO(g) △H=+180.7kJ/mol
ⅱ.2NO(g)+2CO(g) N2(g)+2CO2(g) △H=-746.5kJ/mol
N2(g)+2CO2(g) △H=-746.5kJ/mol
(1)能表示CO燃烧热的热化学方程式为__________________。
(2)反应ⅱ在________(填“较高”或“较低”)温度下能自发进行。
(3)T温度时,向10L恒容密闭容器中充入2molNO和2molCO发生反应ii,5min时达到平衡,测得0~5min内该反应速率v(N2)=0.016mol·L-1·min-1。
①T温度时,该反应的平衡常数K=____________________。
②平衡时容器内压强与起始时容器内压强之比为_________________。
(4)一定条件下,向起始容积为5L的恒压密闭容器充入1molN2和1molO2发生反应i。O2的平衡转化率(α)与温度(T)的关系如图1所示;正反应的平衡常数(K)与温度(T)的关系如图2所示。
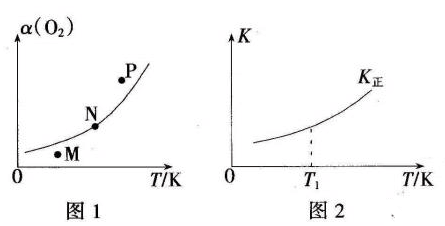
①图1中,M、N、P三点所对应的状态下,v(正)>v(逆)的是_______(填字母),理由为______。
②T1温度时,K正=1,则O2的平衡转化率为________(保留三位有效数字);在图2中画出逆反应平衡常数(K逆)与温度(T)的关系曲线。________
-
按要求回答下列问题
(1)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为____________________。
(2)已知碳的燃烧热ΔH1= a kJ·mol-1,S(s)+2K(s)=K2S(s);ΔH2= b kJ·mol-12K(s)+N2(g)+3O2(g)=2KNO3(s) ΔH3= c kJ·mol-1,则S(s)+2KNO3(s)+3C(s)=K2S(s)
+N2(g)+3CO2(g) ΔH=____________________。
(3)已知:C(s)+O2(g)=CO2(g) ΔH=-437.3 kJ·mol一1,H2(g)+1/2O2(g)=H2O(g) ΔH=-285.8 kJ·mol一1,CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJ·mol一1,写出煤气化(碳和水蒸气反应生成一氧化碳和氢气)的热化学方程式________,计算10m3(标况)水煤气完全燃烧放出的热量为_________kJ(结果保留到小数点后一位)。
-
氮元素在自然界中存在十分广泛,在生物体内亦有极大作用,是组成氨基酸的基本元素之一。氮及其化合物在生产生活中应用广泛。氮的氢化物种类繁多,其中最重要的是氨气,液态氨是一种很好的溶剂,在许多性质方面和水非常相似。
请回答:
 纯水中存在电离平衡:
纯水中存在电离平衡: 。像水一样,纯液氨中也存在着微弱的电离作用,请写出液氨的电离方程式________。
。像水一样,纯液氨中也存在着微弱的电离作用,请写出液氨的电离方程式________。
 金属钠可以从水中置换氢。在铁作催化剂时,金属钠也可以和液氨反应产生氢气和一种离子化合物X,该反应的化学方程式为____________________________,X的电子式是_____________。
金属钠可以从水中置换氢。在铁作催化剂时,金属钠也可以和液氨反应产生氢气和一种离子化合物X,该反应的化学方程式为____________________________,X的电子式是_____________。
2NH3(g)已达平衡状态的是____。



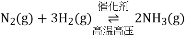 △H=a kJ/mol
△H=a kJ/mol



