-
以Al和不同的铜盐溶液间的反应为实验对象,探索Al与不同铜盐溶液反应的多样性。
| 实验 | 向试管中加入2ml溶液 | 实验现象 |
| 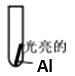
| 实验Ⅰ:0.5mol/LCuCl2溶液 | 15s:大量气泡且有红色物质析出 60s:反应进一步加快且反应剧烈放热,液体几乎沸腾 120s:铝片反应完,试管中析出大量蓬松的红色物质 |
| 实验Ⅱ:0.5mol/LCuSO4溶液 | 15s 无明显现象 60s:铝片表面有极少气泡 120s:有少量气泡溢出,铝片边缘有很少红色物质生成 |
(1)对实验Ⅰ进行研究②④
①实验Ⅰ中生成红色物质的离子方程式为:____________________________
经检验实验Ⅰ中产生的气体为氢气,用离子方程式解释溶液中存在H+的原因:_____________________
③请写出60s后反应进一步加快可能的原因(写出两条)_____________________________
(2)对实验Ⅱ进行研究
实验Ⅱ反应明显比实验Ⅰ缓慢,说明Al与不同的铜盐溶液反应呈现多样性,其原因可能有:
假设一:SO42-对Al与Cu2+的置换反应存在一定的抑制作用。
假设二:________________________
(3)为进一步研究上述假设,设计如下实验:
| 实验 | 向试管中加入2mL溶液 | 实验现象 |
| 
| 实验Ⅲ:0.5mol/LCuCl2溶液+1g Na2SO4固体 | 加入 Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 |
| 实验Ⅳ:0.5mol/L CuCl2溶液+5g Na2SO4固体 | 加入Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 |
| 实验Ⅴ:0.5mol/LCuSO4溶液+0.02mol NaCl固体 | 未加入 NaCl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 |
| 实验Ⅵ:0.5mol/LCuSO4溶液+_________ NH4Cl固体 | 未加入 NH4Cl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 |
_____________________________________
其中,实验Ⅰ与实验Ⅲ、Ⅳ做对比,结论为:______________________________________
其中,实验Ⅱ与实验Ⅴ、Ⅵ做对比,结论为:______________________________________
(4)请设计实验证明Cl-对Al与H+的反应同样起到相似的作用:_________________
-
以Al和不同的铜盐溶液间的反应为实验对象,探索Al与不同铜盐溶液反应的多样性。
| 实验 | 向试管中加入2ml溶液 | 实验现象 |
| 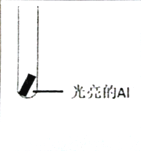
| 实验Ⅰ:0.5mol/LCuCl2溶液 | 15s:大量气泡且有红色物质析出 60s:反应进一步加快且反应剧烈放热,液体几乎沸腾 120s:铝片反应完,试管中析出大量蓬松的红色物质 |
| 实验Ⅱ:0.5mol/LCuSO4溶液 | 15s无明显现象 60s:铝片表面有极少气泡 120s:有少量气泡溢出,铝片边缘有很少红色物质生成 |
(1)对实验Ⅰ进行研究
①实验Ⅰ中生成红色物质的离子方程式为: __________________________________________
②请写出60s后反应进一步加快可能的原因(写出一条)________________________________________________________________
(2)对实验Ⅱ进行研究
①实验Ⅱ反应明显比实验Ⅰ缓慢,说明Al与不同的铜盐溶液反应呈现多样性,其原因可能有:
②假设一:SO 4 2-对Al与Cu 2+的置换反应存在一定的抑制作用。
③假设二:________________________________________________
(3)为进一步研究上述假设,设计如下实验:
| 实验 | 向试管中加入2mL溶液 | 实验现象 |
| 
| 实验Ⅲ:0.5mol/LCuCl2溶液+1g Na2SO4固体 | 加入 Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 |
| 实验Ⅳ:0.5mol/L CuCl2溶液+5g Na2SO4固体 | 加入Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 |
| 实验Ⅴ:0.5mol/LCuSO4溶液+0.02mol NaCl固体 | 未加入 NaCl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 |
| 实验Ⅵ:0.5mol/LCuSO4溶液+_________ NH4Cl固体 | 未加入 NH4Cl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 |
①实验Ⅵ的设计目的是:_______________________________________________
②其中,实验Ⅰ与实验Ⅲ、Ⅳ做对比,结论为:______________________________
③其中,实验Ⅱ与实验Ⅴ、Ⅵ做对比,结论为:________________________________
-
某化学兴趣小组设计实验探究Mg与盐溶液反应的多样性。
| 实验 | 向试管中加2mL溶液 | 实验现象 |
| 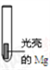
| 实验I: 0.1 mol/L AgNO3溶液 | 镁条表面迅速覆盖一层疏松黑色固体,并有少量气泡产生 |
| 实验II: 2.0 mol/L NH4Cl溶液 | 反应开始时产生大量气体(经检验其中含有H2),一段时间后产生使湿润的红色石蕊试纸变蓝的气体 |
| 实验III: pH=8.2 NaHCO3溶液 | 产生大量气体(经检验其中含有H2和CO2)和白色固体 |
请回答下列问题:
(1)对实验I进行研究:
① 推测实验Ⅰ中黑色固体为Ag,则发生反应的离子方程式为_______________。
② 确认黑色固体为Ag的实验方案是___________________________________。
(2)对实验II进行研究:
① 反应开始时产生H2的原因可能是Mg和NH4+直接反应,或 ___________。
② “一段时间后”产生的气体一定含有H2和_____。
③ 为进一步研究,设计如下实验:
| 实验 | 操作 | 现象 |
| 实验IV | 向装有相同镁条的试管中加入2mL1.0mol/L (NH4)2SO4溶液 | 产生气体的速率明显慢于实验II |
结合实验II、IV,可以得出的结论是________________________________。
(3)对实验III进行研究:
①经检验,白色固体为碱式碳酸镁[ Mg2(OH)2CO3 ]。
②推测在pH=8.2的该溶液中,若无HCO3-,则H+和Mg反应的程度很小。通过实验证实了该推测,其实验操作是__________________________。
(4)根据上述实验判断,影响Mg与盐溶液反应多样性的原因有_______(填字母序号)
A.盐溶液中阳离子的氧化性 B.盐溶液的温度
C.含Mg生成物的溶解性 D.盐溶液中阴离子的影响
-
某化学兴趣小组设计实验探究Mg与盐溶液反应的多样性。
| 实验 | 向试管中加2mL溶液 | 实验现象 |
| 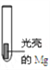
| 实验I: 0.1 mol/L AgNO3溶液 | 镁条表面迅速覆盖一层疏松黑色固体,并有少量气泡产生 |
| 实验II: 2.0 mol/L NH4Cl溶液 | 反应开始时产生大量气体(经检验其中含有H2),一段时间后产生使湿润的红色石蕊试纸变蓝的气体 |
| 实验III: pH=8.2 NaHCO3溶液 | 产生大量气体(经检验其中含有H2和CO2)和白色固体 |
请回答下列问题:
(1)对实验I进行研究:
① 推测实验Ⅰ中黑色固体为Ag,则发生反应的离子方程式为_______________。
② 确认黑色固体为Ag的实验方案是___________________________________。
(2)对实验II进行研究:
① 反应开始时产生H2的原因可能是Mg和NH4+直接反应,或 ___________。
② “一段时间后”产生的气体一定含有H2和_____。
③ 为进一步研究,设计如下实验:
| 实验 | 操作 | 现象 |
| 实验IV | 向装有相同镁条的试管中加入2mL1.0mol/L (NH4)2SO4溶液 | 产生气体的速率明显慢于实验II |
结合实验II、IV,可以得出的结论是________________________________。
(3)对实验III进行研究:
①经检验,白色固体为碱式碳酸镁[ Mg2(OH)2CO3 ]。
②推测在pH=8.2的该溶液中,若无HCO3-,则H+和Mg反应的程度很小。通过实验证实了该推测,其实验操作是__________________________。
(4)根据上述实验判断,影响Mg与盐溶液反应多样性的原因有_______(填字母序号)
A.盐溶液中阳离子的氧化性 B.盐溶液的温度
C.含Mg生成物的溶解性 D.盐溶液中阴离子的影响
-
以CuSO4溶液和不同酸根离子形成的钠盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
| 实验 | 试剂 | 现象 |
| 
| 滴管 | 试管 |
| 0.2mol•L-1 CuSO4溶液 | 0.2mol•L-1NaI溶液 | Ⅰ.产生白色沉淀和黄色溶液 |
| 0.2mol•L-1Na2CO3溶液 | Ⅱ.产生绿色沉淀和无色无味气体 |
| 0.2mol•L-1Na2SO3溶液 | Ⅲ.产生棕黄色沉淀 |
(1)经检验,现象Ⅰ的白色沉淀为CuI,则反应的离子方程式为___,氧化产物与还原产物的物质的量之比为___。
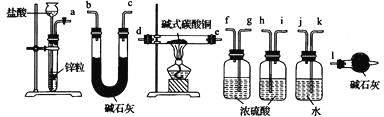
(2)经检验,现象Ⅱ中产生的气体是二氧化碳,绿色沉淀是碱式碳酸铜[xCuCO3•yCu(OH)2•zH2O]。现采用氢气还原法测定碱式碳酸铜组成,请回答如下问题:
①写出xCuCO3•yCu(OH)2•zH2O与氢气反应的化学方程式___;
②实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填仪器接口字母编号):a→___→gf→___→___→___→l
(3)经检验,现象Ⅲ的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-。已知:Cu+ Cu+Cu2+
Cu+Cu2+
①用稀硫酸证实沉淀中含有Cu+的实验现象是___。
②通过下列实验证实,沉淀中含有Cu2+和SO32-。
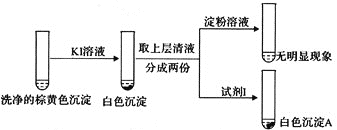
a.白色沉淀A是BaSO4,试剂Ⅰ是___。
b.证实沉淀中含有Cu2+和SO32-的理由是___。
-
以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
| 实验 | 试剂 | 现象 |
| 滴管 | 试管 |
| 
| 0.2mol·L-1Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
| 0.2mol·L-1CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 |
| 0.1mol·L-1Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 |
(1)经验检,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:__________。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含 ,含有Cu+、Cu2+和
,含有Cu+、Cu2+和 。
。
已知:Cu+ Cu+Cu2+,Cu2+
Cu+Cu2+,Cu2+ CuI↓(白色)+I2。
CuI↓(白色)+I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是__________。
②通过下列实验证实,沉淀中含有Cu2+和 。
。

a.白色沉淀A是BaSO4,试剂1是__________。
b.证实沉淀中含有Cu2+和 的理由是__________。
的理由是__________。
(3)已知:Al2(SO3)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无 ,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和__________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:
i.Al(OH)3所吸附;
ii.存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。
a.将对比实验方案补充完整。
步骤一:

步骤二:__________(按上图形式呈现)。
b.假设ii成立的实验证据是__________。
(4)根据实验,亚硫酸盐的性质有__________。盐溶液间反应的多样性与__________有关。
-
以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
| 实验 | 试剂 | 现象 |
| 滴管 | 试管 |
| 
| 0.2mol·L-1Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
| 0.2mol·L-1CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 |
| 0.1mol·L-1Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 |
(1)经验检,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:__________。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含 ,含有Cu+、Cu2+和
,含有Cu+、Cu2+和 。
。
已知:Cu+ Cu+Cu2+,Cu2+
Cu+Cu2+,Cu2+ CuI↓(白色)+I2。
CuI↓(白色)+I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是__________。
②通过下列实验证实,沉淀中含有Cu2+和 。
。

a.白色沉淀A是BaSO4,试剂1是__________。
b.证实沉淀中含有Cu2+和 的理由是__________。
的理由是__________。
(3)已知:Al2(SO3)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无 ,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和__________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:
i.Al(OH)3所吸附;
ii.存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。
a.将对比实验方案补充完整。
步骤一:

步骤二:__________(按上图形式呈现)。
b.假设ii成立的实验证据是__________。
(4)根据实验,亚硫酸盐的性质有__________。盐溶液间反应的多样性与__________有关。
-
以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
| 实验 | 试剂 | 现象 |
| 滴管 | 试管 |
| 
2 mL | 0.2 mol·L−1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
| 0.2 mol·L−1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 |
| 0.1 mol·L−1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 |
| | | |
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:____________。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42−,含有Cu+、Cu2+和SO32−。
已知:Cu+ Cu +Cu2+,Cu2+
Cu +Cu2+,Cu2+ CuI↓(白色)+I2。
CuI↓(白色)+I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是_____________。
②通过下列实验证实,沉淀中含有Cu2+和SO32−。
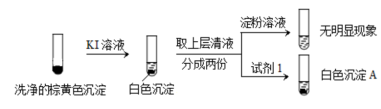
a.白色沉淀A是BaSO4,试剂1是____________。
b.证实沉淀中含有Cu+和SO32−的理由是_______________。
(3)已知:Al2(SO3)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42−,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和____________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:i. Al(OH)3所吸附;ii.存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。
将对比实验方案补充完整。
步骤一:
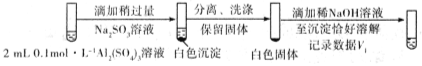
步骤二:

则V1___________V2(填>,<或=)。
(4)根据实验,亚硫酸盐的性质有___________。盐溶液间反应的多样性与__________有关。
-
以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
| 实验 | 试剂 | 现象 |
| 滴管 | 试管 |
| 
2 mL | 0.2 mol·L−1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
| 0.2 mol·L−1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 |
| 0.1 mol·L−1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 |
| | | |
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:____________。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42−,含有Cu+、Cu2+和SO32−。
已知:Cu+  Cu +Cu2+,Cu2+
Cu +Cu2+,Cu2+  CuI↓(白色)+I2。
CuI↓(白色)+I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是_____________。
②通过下列实验证实,沉淀中含有Cu2+和SO32−。
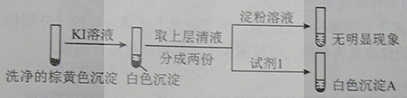
a.白色沉淀A是BaSO4,试剂1是____________。
b.证实沉淀中含有Cu+和SO32−的理由是___________。
(3)已知:Al2(SO3)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42−,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:i.呗Al(OH)3所吸附;ii.存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。
a.将对比实验方案补充完整。
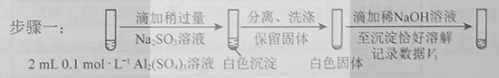
步骤二:_____________(按上图形式呈现)。
(4)根据实验,亚硫酸盐的性质有___________。盐溶液间反应的多样性与__________有关。
-
以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
| 实验 | 试剂 | 现象 |
| 滴管 | 试管 |
| 
2 mL | 0.2 mol·L−1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
| 0.2 mol·L−1 CuSO4溶液 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 |
| 0.1 mol·L−1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 |
| | | |
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:____________。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42−,含有Cu+、Cu2+和SO32−。
已知:Cu+ Cu +Cu2+,Cu2+
Cu +Cu2+,Cu2+ CuI↓(白色)+I2。
CuI↓(白色)+I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是_____________。
②通过下列实验证实,沉淀中含有Cu2+和SO32−。
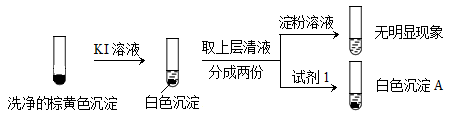
KI溶液 洗净的棕黄色沉淀 取上层清液 分成两份 淀粉溶液 试剂1 无明显现象
白色沉淀A
a.白色沉淀A是BaSO4,试剂1是____________。
b.证实沉淀中含有Cu2+和SO32−的理由是___________。
(3)已知:Al2(SO4)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42−,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:
i.被Al(OH)3所吸附;
ii.存在于铝的碱式盐中。
对假设ii设计了对比实验,证实了假设ii成立。
a.将对比实验方案补充完整。
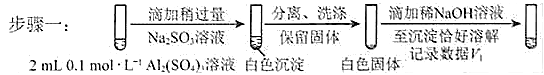
步骤二:_____________(按上图形式呈现)。
(4)根据实验,亚硫酸盐的性质有___________。盐溶液间反应的多样性与__________有关。


















 Cu +Cu2+,Cu2+
Cu +Cu2+,Cu2+ 



