-
为了减轻大气污染,可在汽车尾气排放处加装“催化净化器”装置.
(1)通过“催化净化器”的 CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的化学方程式是 .
(2)在一定温度下,向1L密闭恒容容器中充入0.5mol NO、2mol CO,发生上述反应,20S时反应达平衡,此时CO的物质的量为1.6mol.请回答下列问题:
①前20s内平均反应速率v(CO)为 .
②在该温度下反应的平衡常数K= .
③关于上述反应,下列叙述不正确的是 (填编号).
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度不变,再向容器中充入0.4molCO和0.8mol N2,则此时v正>v逆
④已知上述实验中,c(CO)与反应时间t变化曲线Ⅰ.
若其它条件不变,将0.5mol NO、2mol CO投入2L容器进行反应,请在图1绘出c(CO)与反应时间t1变化曲线Ⅱ .
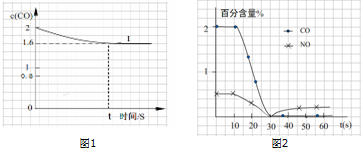
(3)测试某汽车冷启动时的尾气催化处理CO、NO百分含量随时间变化曲线如图2,请回答:前0﹣10s 阶段,CO、NO百分含量没明显变化的原因是 .
-
为了减轻大气污染,可在汽车尾气排放处加装“催化净化器”装置。
(1)通过“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的化学方程式:__。
(2)在一定温度下,向1L密闭恒容容器中充入1molNO、2molCO,发生上述反应,10s时反应达到平衡,此时CO的物质的量为1.2mol。请回答下列问题:
①前10s内平均反应速率v(CO)=___。
②在该温度下反应的平衡常数K=___。
③关于上述反应,下列叙述正确的是___(填字母)。
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.扩大容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度不变,再向容器中充入0.8molCO和0.4molN2,则此时v正>v逆
④已知上述实验中,c(CO)与反应时间t变化曲线Ⅰ如图:
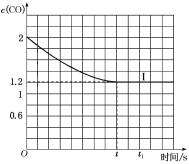
若其他条件不变,将1molNO、2molCO投入2L容器进行反应,请在图中绘出c(CO)与反应时间t1变化曲线Ⅱ___(不要求标出CO的终点坐标)。
(3)测试某汽车冷启动时的尾气催化处理,CO、NO百分含量随时间变化曲线如图:
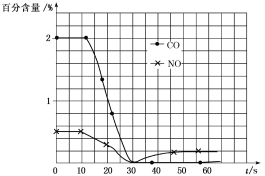
请回答:
前0~10s阶段,CO、NO百分含量没明显变化的原因是___。
-
(1)汽车尾气中常常含有CO、NOx等气体,为减轻污染,当代汽车都加装了“三效催化净化器”,可将汽车尾气中的有毒气体处理为无污染的气体,下图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子。

下列说法中正确的是________。
A.该反应是置换反应
B.该反应中乙被氧化了,发生了还原反应
C.每生成2mol生成物,该反应共转移16/5mol电子
D.使用催化净化器的汽车必须使用无铅汽油,因为含铅化合物会使催化剂中毒
 (2)NH3的催化氧化也可产生NO,某化学课外活动小组设计了下图所示的实验装置,进行“氨的催化氧化”实验(固定装置略去)。
(2)NH3的催化氧化也可产生NO,某化学课外活动小组设计了下图所示的实验装置,进行“氨的催化氧化”实验(固定装置略去)。
①若A中使用的药品是碳酸氢铵,则在下列仪器中,A中未画出的仪器有________(填序号)。
a.乱分液漏斗 b.试管 c.烧瓶 d.酒精灯 e.导气管 f.橡胶塞
②装置B的作用是:________。
③装置C中发生反应的化学方程式为________。
④若A、B中药品足量,则装置D中可以观察到的现象是________。
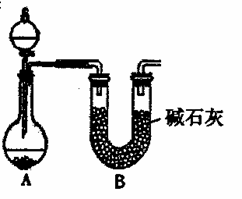 ⑤指导老师从安全与环保的角度考虑,指出该装置有两处明显的缺陷。请你提出修改建议:a.________;
⑤指导老师从安全与环保的角度考虑,指出该装置有两处明显的缺陷。请你提出修改建议:a.________;
b.________。
(3)一些同学提出也可将上述所示装置中A、B
部分换成右图所示装置进行实验。则反应开
始前:
①分液漏斗中盛放的药品是________;
②烧瓶中发生反应的化学方程式为:
________。
-
为减轻环境污染,北京为汽车加装了“三元催化净化器”,可将尾气中的一氧化碳、一氧化氮转化为参与大气循环的无毒的混合气体,该混合气体是
A.二氧化碳和氮气 B.二氧化碳和二氧化氮
C.二氧化碳和氧气 D.二氧化碳和氧化二氮
-
汽车尾气排放的CO、NOx等气体是大气污染的主要来源,NOx也是雾霾天气的主要成因之一。
i.在汽车排气管加装催化转化器,可有效降低污染物的浓度,发生反应:2NO(g)+2CO(g) N2(g)+2CO2(g)△H<0。为了模拟催化转化器的工作原理,在t℃时,将2molNO与1mol CO充入1L反应容器中,反应过程中NO(g)、CO(g)、N2(g)的物质的量变化如图所示,
N2(g)+2CO2(g)△H<0。为了模拟催化转化器的工作原理,在t℃时,将2molNO与1mol CO充入1L反应容器中,反应过程中NO(g)、CO(g)、N2(g)的物质的量变化如图所示,
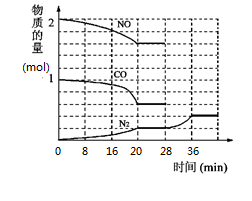
(1)①则反应进行到20min时,CO2的平均反应速率为________________.
②28min~36min内NO、CO、N2的物质的量发生了变化(NO、CO图像未画出),引起该变化的条件可能是______.
a.加入催化剂 b.通入0.2mol N2
c.缩小容器体积 d.增加CO2的物质的量
③当36min达到平衡后,若保持体系温度为t℃,再向容器中充入CO、CO2气体,使两者物质的量浓度均加倍,平衡将__________移动(填“向左”、“向右”或“不”)
(2)若均取2molNO和1molCO的混合气体分别放入3种不同的容器中进行该反应,A容器保持恒温恒压,B容器保持恒温恒容,C容器保持恒容绝热,且初始时3个容器的容积和温度均相同,下列说法正确的是______.
a.3个容器中NO的平衡转化率的大小顺序为 aA>aB>aC.
b.当A容器内气体的平均摩尔质量不变时,说明该反应处于化学平衡状态
c.A、B两个容器达到平衡所用的时间:tA>tB
d.当C容器内平衡常数不变时,说明该反应处于化学平衡状态
ii. 某温度下,NO2(g)+SO2(g)⇌SO3(g)+NO(g)的平衡常数K= ,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如表所示,
,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如表所示,
| 起始浓度 | 甲 | 乙 | 丙 |
| c(NO2)/mol•L﹣1 | 0.10 | 0.20 | 0.20 |
| c(SO2)/mol•L﹣1 | 0.10 | 0.10 | 0.20 |
(3)①10min后,甲中达到平衡,则甲中NO2的转化率α(NO2)=_______________.
②达到平衡后,设甲、乙、丙中SO2(g)的转化率分别为a、b、c,则三者的大小关系为_____________.
(4)利用反应NO2+NH3→N2+H2O(未配平)消除NO2的简易装置如图所示。
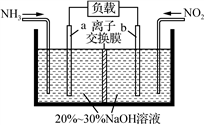
电极b的电极反应式为__________________;常温下,若用该电池电解0.6L饱和食盐水,消耗标准状况下448mL NH3时, 发现两极产生相同体积的气体,则此时溶液的PH=____(假设电解过程溶液体积不变)。
-
(12分)
(l)当前频繁出现的雾霾天气与汽车尾气的排放有一定的关系,为了减少污染,可尝试使用汽车尾气净化装置,其原理如图所示。
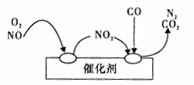
写出净化过程中的总化学反应方程式 。
(2)目前科学家也在尝试用Cu+做催化刘,将汽车尾气中NO2转化为无毒的N2,其原理如下图所示:
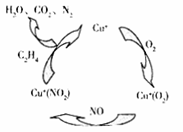
①该过程中,还原剂是 《填物质名称).
②若某辆汽车的NO排放为0.09g/km.则该车行驶100km.完成上述转化理论上需消耗乙烯的质量为 g.
(3)为探究本地区雾霾中的可溶性颗粒的成分,某化学研究性小组进行了实验探究.
[查阅资料]雾霾颗粒样品中可能含有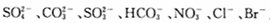 及一种常见阳离子
及一种常见阳离子 .现进行如下实脸
.现进行如下实脸

请回答下列问题:
①根据上述实验,雾霾浸取液中一定含有的离子是 _,肯定没有的离子是_ .
②若气体D遇空气会空成红棕色,则沉淀A中一定含有_ (填化学式).
-
去年下半年我省雾霾天气十分严重。PM2.5细颗粒物含有的毒性物质来源之一是汽车尾气排放。通过排气管加装催化装置,可有效减少CO和NO的排放,催化装置内发生的反应为:NOx+CO—催化剂→N2+CO2,下列关于此反应的说法中,不正确的是
A.所涉及元素的第一电离能:N>O>C
B.当x=2时,每生成1molN2,转移电子数为4mol
C.等物质的量N2和CO2中, 键的个数比为1:1
键的个数比为1:1
D.氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价
-
 细颗粒物含有的毒性物质来源之一是汽车尾气排放。通过排气管加装催化装置,可有效减少CO和NO的排放,催化装置内发生的反应为:2NOx+2xCO
细颗粒物含有的毒性物质来源之一是汽车尾气排放。通过排气管加装催化装置,可有效减少CO和NO的排放,催化装置内发生的反应为:2NOx+2xCO N2+2xCO2,下列关于此反应的说法中,错误的是( )
N2+2xCO2,下列关于此反应的说法中,错误的是( )
A.所涉及元素中原子半径: 
B.氧化剂与还原剂的物质的量之比为1:1时, 中氮元素的化合价为
中氮元素的化合价为 价
价
C.当 时,每生成1molN2,转移电子数为4mol,
时,每生成1molN2,转移电子数为4mol, 为氧化产物
为氧化产物
D.等物质的量 和
和 中,共价键的个数比为
中,共价键的个数比为
-
去年下半年我省雾霾天气十分严重。PM2.5细颗粒物含有的毒性物质来源之一是汽车尾气排放。通过排气管加装催化装置,可有效减少CO和NO的排放,催化装置内发生的反应为:NOx+CO→N2+CO2,下列关于此反应的说法中,不正确的是
A.所涉及元素的第一电离能:N>O>C
B.当x=2时,每生成1molN2,转移电子数为4mol
C.等物质的量N2和CO2中, 键的个数比为1:1
键的个数比为1:1
D.氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价
-
汽车尾气中排放的NO和CO,可以通过加装催化转化器,使之转化为两种无污染的气体,
2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-748 kJ/mol
N2(g)+2CO2(g) ΔH=-748 kJ/mol
在一定温度下,向2L的密闭容器中充入2.0molNO2.0molCO,在催化剂作用下发生反应,相关数据如下:
| 0 min | 5min | 10min | 15min | 20min |
| c(NO) | 1.0 | 0.6 | 0.3 | 0.2 | 0.2 |
| c(N2) | 0 | 0.2 | 0.35 | 0.4 | 0.4 |
(1)5—10min,用CO的浓度变化表示的反应速率为: ;
(2)能说明上述反应达到平衡状态的是
A.2正(NO) =逆(N2) B.混合气体的平均相对分子质量不变
C.NO和CO的转化率相等 D.容器内气体压强不变
(3)20min时,向容器中加入1molNO和1molCO,再次达到平衡时,NO的转化率: (填“变大”、“ 变小”或“不变”)。
(4)计算此温度下的化学平衡常数K= ,或保持温度不变,此时再向容器内加入CO和CO2各1mol,平衡 移动(填“向左”、“ 向右”或“不”)。
(5)若反应开始向容器中加入1molN2和2molCO2,反应达到平衡时,吸收热量为 kJ。



 (2)NH3的催化氧化也可产生NO,某化学课外活动小组设计了下图所示的实验装置,进行“氨的催化氧化”实验(固定装置略去)。
(2)NH3的催化氧化也可产生NO,某化学课外活动小组设计了下图所示的实验装置,进行“氨的催化氧化”实验(固定装置略去)。 ⑤指导老师从安全与环保的角度考虑,指出该装置有两处明显的缺陷。请你提出修改建议:a.________;
⑤指导老师从安全与环保的角度考虑,指出该装置有两处明显的缺陷。请你提出修改建议:a.________;



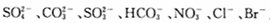 及一种常见阳离子
及一种常见阳离子